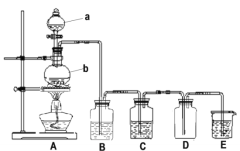
题目内容
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
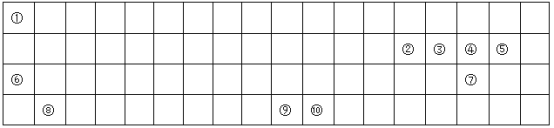
请回答下列问题:
(1)在表中画出元素周期表前四周期的边框______。
(2)表中属于d区的元素符号为________,其基态原子的价层电子排布图为__________。
(3)元素①与②形成的一种化合物是重要的化工原料,常把该物质的产量作为衡量石油化工发展水平的标志。有关该分子的说法正确的是_____ 。
A.分子间存在氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该分子中,中心原子采用sp2杂化
(4)①、③、④、⑦、⑩五种元素形成的一种常见的深蓝色配合物, 其化学式为_____________
1摩尔配合离子所含σ键个数为__________,配体分子的空间构型为_______ ;与该配体分子互为等电子体的阳离子的符号为___________。
(5)③、④、⑥三种元素第二电离能从小到大依次为:___________(用元素符号填空)。
(6)元素⑩的焰色为绿色,很多金属元素能形成焰色反应的原因为_________________。
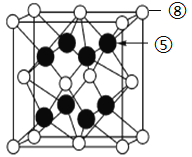
(7) ⑧与⑤形成离子化合物的晶胞结构如图所示。可以用____________方法区分晶体和非晶体。该晶胞中,⑧离子的配位数为_____________;若晶体的密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中最近的两个⑤离子间距离为_________________pm(用代数式表示)。
【答案】 Ni
Ni ![]() BD [Cu(NH3)4]SO4·H2O 16NA 三角锥形 H3O+ N<O<Na 电子从较多高能量的激发态跃迁到能量低的激发态或基态时,常以一定波长光的形式释放能量,形成焰色反应 X射线衍射实验法 8
BD [Cu(NH3)4]SO4·H2O 16NA 三角锥形 H3O+ N<O<Na 电子从较多高能量的激发态跃迁到能量低的激发态或基态时,常以一定波长光的形式释放能量,形成焰色反应 X射线衍射实验法 8 ![]() ×
×![]() ×1010
×1010
【解析】
根据元素在周期表中的位置可知,①为H元素,②为C元素,③为N元素,④为O元素,⑤为F元素,⑥为Na元素,⑦为S元素,⑧为Ca元素,⑨为Ni元素,⑩为Cu元素,结合原子结构和晶胞的计算方法分析解答。
(1)元素周期表前四周期的边框如图 ,故答案为:
,故答案为: ;
;
(2)表中属于d区的元素为Ni,Ni为28号元素,其基态原子的价层电子排布图为![]() ,故答案为:Ni;
,故答案为:Ni;![]() ;
;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为乙烯(C2H4)。
A.C元素电负性不大,分子间不存在氢键,故A错误;
B.乙烯为平面对称结构,正负电荷重心重合,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子含有1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(4)①、③、④、⑦、⑩五种元素形成的一种常见的深蓝色配合物,其化学式为[Cu(NH3)4]SO4·H2O,配合离子[Cu(NH3)4]2+中生成4个配位键,1个氨气分子中含有3个σ键,因此1个配离子中含有σ键=4+3×4=16,因此 1摩尔该配合离子含有σ键个数为16NA,配体为氨气分子,NH3分子中N含有3个成键电子对和1个孤电子对,采用sp3杂化,空间构型为三角锥形;与NH3分子互为等电子体的阳离子为H3O+,故答案为:[Cu(NH3)4]SO4·H2O;16NA;三角锥形;H3O+;
(5) 气体Na+从8电子稳定结构再失去1个电子最难,气体基态O+从2p3半充满稳定结构再失去1个电子较气体基态N+从2p2失去1个电子更难,故第二电离能:N<O<Na,故答案为:N<O<Na;
(6)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为:电子从较多高能量的激发态跃迁到能量低的激发态或基态时,常以一定波长光的形式释放能量,形成焰色反应,故答案为:电子从较多高能量的激发态跃迁到能量低的激发态或基态时,常以一定波长光的形式释放能量,形成焰色反应;
(7)晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X-射线衍射可以看到微观结构,通过X射线衍射实验可以区分晶体和非晶体;黑色球为F,白色球为Ca,晶胞中F原子数目为8,Ca原子数目为8×![]() +6×
+6×![]() =4,氟离子配位数为4,原子配位数与原子数目成反比,则钙离子配位数为8;晶胞质量为
=4,氟离子配位数为4,原子配位数与原子数目成反比,则钙离子配位数为8;晶胞质量为![]() span>g,该晶体的密度为agcm-3,则该晶胞的体积是为
span>g,该晶体的密度为agcm-3,则该晶胞的体积是为![]() g÷agcm-3=
g÷agcm-3=![]() cm3,则晶胞的棱长=
cm3,则晶胞的棱长=![]() cm=
cm=![]() ×1010pm,根据图示,晶胞中最近的两个⑤离子间距离为晶胞棱长的一半=
×1010pm,根据图示,晶胞中最近的两个⑤离子间距离为晶胞棱长的一半=![]() ×
×![]() ×1010pm,故答案为:X射线衍射实验法;8;
×1010pm,故答案为:X射线衍射实验法;8;![]() ×
×![]() ×1010。
×1010。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____________。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
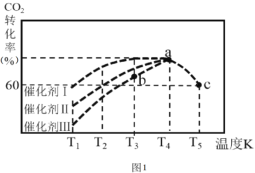
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
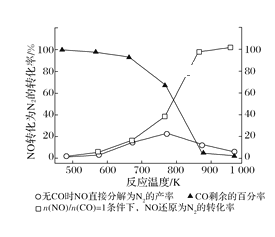
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
活性炭 | NO | E | F | |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①若T1<T2,则该反应的△H _________ 0(填“>”“<”或“=”)。
②上述反应T1℃时达到化学平衡后再通入0.10molNO气体,则达到新化学平衡时NO的总转化率为_____________。