题目内容
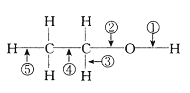
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O △H<0。下列有关说法正确的是( )
CO2+H2O △H<0。下列有关说法正确的是( )
A. 该反应为吸热反应
B. CO2分子中的化学键为非极性键
C. HCHO分子中既含σ键又含π键
D. 每生成1.8g H2O消耗2.24 L O2
【答案】C
【解析】
A、根据大多数放热反应在常温下能进行分析;
B.根据不同种元素形成的共价键为极性键分析;
C.根据一个单键就是一个σ键,一个双键是由一个σ键和一个π键组成分析;
D.根据气体的体积与温度、压强有关分析。
A. 该反应在室温下可以进行,故该反应为放热反应,A项错误;
B. 二氧化碳结构为O=C=O,为极性键,B项错误;
C. 甲醛中,含有碳氧双键以及两个碳氢单键,故其中含有3个σ键,1个π键,C项正确;
D. 每生成1.8g H2O消耗氧气的物质的量为0.1,没有标明状况,故不一定为2.24L,D项错误;
答案选C。

【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |