题目内容
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____________。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
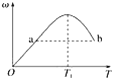
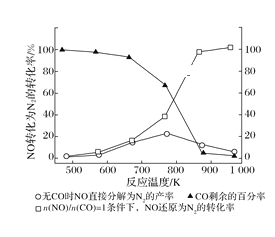
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
活性炭 | NO | E | F | |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①若T1<T2,则该反应的△H _________ 0(填“>”“<”或“=”)。
②上述反应T1℃时达到化学平衡后再通入0.10molNO气体,则达到新化学平衡时NO的总转化率为_____________。
【答案】D NO的分解为放热反应,升高温度不利于反应正向进行 870K(850-900K之间均可) < 80%
【解析】
(1)汽缸中生成NO的反应N2(g)+O2(g)2NO(g)—Q,该反应为气体分子数不变的放热反应。
(2)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,反应为放热反应。
(3)从表中数据可知,碳、NO、E和F的化学计量数之比为(3.000-2.960):(0.10-0.020):0.04:0.04=1:2:1:1,得到反应方程式C+2NO![]() N2+CO2。
N2+CO2。
(1)当可逆反应的正逆反应速率相等,各组分浓度不再改变时反应达到平衡状态。
A.气体的总质量、容器的体积一直不变,则混合气体的密度一直不变,不能说明达到平衡状态,A错误;
B.反应前后气体的分子数不变,混合气体的压强一直无变化,不能说明达到平衡状态,B错误;
C.N2、O2、NO的物质的量之比为1∶1∶2,不能说明正逆反应速率相等,各组分浓度不再改变,C错误;
D.氧气的转化率不再变化,说明各组分的浓度不再改变,能说明反应达到平衡状态,D正确;
答案选D。
(2)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在![]() =1的条件下,870K (850-900K之间均可)时,NO还原为N2的转化率接近为100%,则为更好的除去NOx,应控制的最佳温度在870K(850-900K之间均可)左右。
=1的条件下,870K (850-900K之间均可)时,NO还原为N2的转化率接近为100%,则为更好的除去NOx,应控制的最佳温度在870K(850-900K之间均可)左右。
(3)①T1 温度下平衡时生成物的物质的量大于T2温度下的,因为T1<T2,说明升高温度平衡逆向移动,反应为放热反应,则该反应的△H<0。
②反应C+2NO![]() N2+CO2是一个气体体积不变的反应,而气态反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为
N2+CO2是一个气体体积不变的反应,而气态反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为![]() ,则达到新平衡时NO的转化率为80%。
,则达到新平衡时NO的转化率为80%。

 名校课堂系列答案
名校课堂系列答案【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |