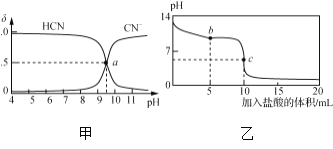
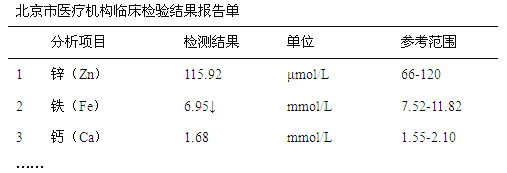
题目内容
【题目】某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):(SiHCl3相对分子质量为:135.5)
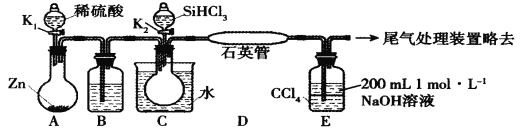
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g·mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)装置C中的烧瓶用水浴加热的优点为_____________________。
(2)装置D中发生反应的化学方程式为_____________________。
(3)装置E的作用为___________________。
(4)相关实验步骤如下,其合理顺序为_______________ (填序号)。
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1; ④关闭K2; ⑤加热装置D至1357 K。
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.1 mol·L-1盐酸滴定,达到滴定终点时,消耗盐酸20.00 mL。达到滴定终点的现象是____________。SiHCl3的利用率为__________%(保留两位小数)。
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___________________
【答案】受热均匀,得到平稳的SiHCl3气流 SiHCl3+H2![]() Si+3HCl 四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸 ②⑤①④③ 溶液红色褪去,且半分钟不变色 93.34 取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸
Si+3HCl 四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸 ②⑤①④③ 溶液红色褪去,且半分钟不变色 93.34 取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸
【解析】
A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,同时利用生成的氢气排尽装置内空气,防止安全事故的发生,在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气,据此分析解答。
(1)装置C中的烧瓶用水浴加热,可以使烧瓶受热均匀,得到平稳的SiHCl3气流,故答案为:受热均匀,得到平稳的SiHCl3气流;
(2)D中经过干燥的氢气与SiHCl3在1357 K反应生成Si与HCl,反应方程式为:SiHCl3+H2![]() Si+3HCl,故答案为:SiHCl3+H2
Si+3HCl,故答案为:SiHCl3+H2![]() Si+3HCl;
Si+3HCl;
(3)装置E中的四氯化碳可以吸收未反应的SiHCl3,氢氧化钠溶液可以吸收HCl,同时导管插入四氯化碳中可以防止倒吸,故答案为:四氯化碳吸收未反应的SiHCl3;氢氧化钠溶液吸收HCl;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,其合理顺序为:②⑤①④③,故答案为:②⑤①④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×![]() =0.18mol,由SiHCl3+H2
=0.18mol,由SiHCl3+H2![]() Si+3HCl,可知参加反应SiHCl3为
Si+3HCl,可知参加反应SiHCl3为![]() =0.06mol,故SiHCl3的利用率为
=0.06mol,故SiHCl3的利用率为![]() ×100%=93.34%,故答案为:溶液红色褪去,且半分钟不变色;93.34;
×100%=93.34%,故答案为:溶液红色褪去,且半分钟不变色;93.34;
(6)检验溶液中含有H+、Cl-可以证明生成HCl,具体实验方案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸,故答案为:取两份溶液,一份加入石蕊试液,变红,另一份加入硝酸酸化的硝酸银溶液,出现白色沉淀,则证明溶液中存在盐酸。

【题目】根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
实验现象 | 离子方程式 |
1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | ______ |
2.制备氢氧化铁胶体的化学方程式 | ______ |
3.二氧化硫使酸性高锰酸钾溶液褪色 | ______ |
4.Fe3O4溶于稀硝酸 | ______ |
5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | ______ |
6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | ______ |
7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | ______ |
8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | ______ |
9.FeI2与Cl2物质的量1∶2反应 | ______ |
10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | ______ |
11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | ______ |
12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | ______ |
13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 | ______ |