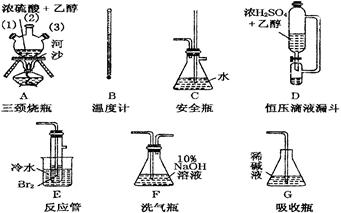
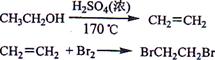
题目内容
(16分)实验室用氯化钠固体配制1.00 mol /L的NaCl溶液100 mL,回答下列问题:
1.主要仪器
托盘天平、量筒、烧杯、玻璃棒、胶头滴管,还需要的玻璃仪器是_______________。
2.配制步骤
(1)计算:根据n=c·V,m=n·M ,则m(NaCl)=__________ g。
(2)称量:用托盘天平准确称取NaCl固体__________g。
(3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解;用玻璃棒搅拌,并冷却至室温。
(4)移液:
(5)洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2-3次,并将洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面距容量瓶颈刻度线1 cm~2 cm时,
改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
右图是该同学转移溶液的示意图,指出图中的错误:
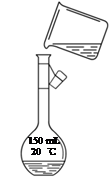
_____________________________________________。
3.若实验遇到下列情况,对NaCl溶液的物质的量浓度有何影响(填写“偏高”、“偏低”或“不变”)?
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。 。
②溶解的NaCl溶液转移到容量瓶中后未洗涤烧杯: 。
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。 。
1.主要仪器
托盘天平、量筒、烧杯、玻璃棒、胶头滴管,还需要的玻璃仪器是_______________。
2.配制步骤
(1)计算:根据n=c·V,m=n·M ,则m(NaCl)=__________ g。
(2)称量:用托盘天平准确称取NaCl固体__________g。
(3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解;用玻璃棒搅拌,并冷却至室温。
(4)移液:
(5)洗涤:用蒸馏水洗涤烧杯内壁及玻璃棒2-3次,并将洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面距容量瓶颈刻度线1 cm~2 cm时,
改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
右图是该同学转移溶液的示意图,指出图中的错误:
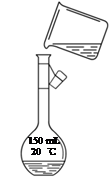
_____________________________________________。
3.若实验遇到下列情况,对NaCl溶液的物质的量浓度有何影响(填写“偏高”、“偏低”或“不变”)?
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。 。
②溶解的NaCl溶液转移到容量瓶中后未洗涤烧杯: 。
③定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。 。
1.主要仪器:100 mL容量瓶。2.配制步骤:(1)5.85 。(2)5.9 。(3)转移液体时没有用玻璃棒引流;容量瓶用的是150 mL应该用100 mL。 3.误差分析:①偏高。②偏低。③偏低。
试题分析:1、实验室配制一定体积准确浓度的溶液。需要的主要仪器托盘天平、量筒、烧杯、玻璃棒、胶头滴管,还有容量瓶(指出规格)。2.配制步骤。(1)计算:根据n=c·V,m=n·M ,将数值代入计算出m(NaCl)=5.85g。(2)称量:由于托盘天平只能读到0.1g,用托盘天平准确称取NaCl固体5.9g。指出图中的错误:转移液体时没有用玻璃棒引流;容量瓶用的是150 mL应该用100 mL规格的。根据误差分析:
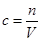 ,①由于热胀冷缩的原因,在未降至室温时,立即将溶液转移至容量瓶定容。实际体积小于100 mL。即V减小了,n不变,故C偏高了。②溶液转移到容量瓶中后未洗涤烧杯,在烧杯中会残留较多的溶质致使n减小,V准确,故C偏低了。③定容后,摇匀后,又滴加蒸馏水至刻度。实际上V增大,n不变,故C偏低了。
,①由于热胀冷缩的原因,在未降至室温时,立即将溶液转移至容量瓶定容。实际体积小于100 mL。即V减小了,n不变,故C偏高了。②溶液转移到容量瓶中后未洗涤烧杯,在烧杯中会残留较多的溶质致使n减小,V准确,故C偏低了。③定容后,摇匀后,又滴加蒸馏水至刻度。实际上V增大,n不变,故C偏低了。点评:配制一定体积准确浓度的溶液需要用到的仪器以及配制步骤,还有误差分析。这是高考的常考点。希望考生加以记忆。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目