题目内容
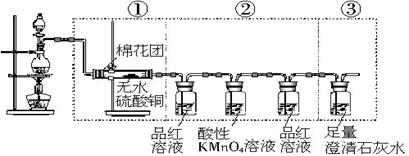
(10分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

(1)装置F中发生反应的离子方程式:___________________。
(2)装置A中的烧瓶内固体可选用________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
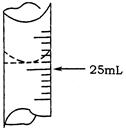
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B__________,D__________,E__________。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵:____________________________。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?________________________________________________________________________________。

(1)装置F中发生反应的离子方程式:___________________。
(2)装置A中的烧瓶内固体可选用________(选填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B__________,D__________,E__________。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵:____________________________。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?________________________________________________________________________________。
(1)MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(2分)
(2)A、B、E(2分)
(3)氨气Ⅰ Ⅱ Ⅲ(3分,每空1分)
(4)取一定量该固体加水溶解,将该溶液分成两份于试管中,向其中一份中加入NaOH溶液,加热,生成的气体能使红色石蕊试纸变红,说明含NH;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵(2分)
(5)将尾气通入盛有NaOH溶液的烧杯中(1分)
(2)A、B、E(2分)
(3)氨气Ⅰ Ⅱ Ⅲ(3分,每空1分)
(4)取一定量该固体加水溶解,将该溶液分成两份于试管中,向其中一份中加入NaOH溶液,加热,生成的气体能使红色石蕊试纸变红,说明含NH;向另一份溶液中加入HNO3酸化,然后加入AgNO3,出现白色沉淀,说明含Cl-;通过上述现象即可证明该固体是氯化铵(2分)
(5)将尾气通入盛有NaOH溶液的烧杯中(1分)
试题分析:(1)、制取Cl2的方程式为MnO2+4HCl=MnCl2+Cl2↑+2H2O,改写成离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
(2)、因为有NH3↑+H2O
 NH3.H2O
NH3.H2O NH4++OH-,只要能产生OH-的物质都可以使平衡向逆向移动生成NH3,故碱石灰、生石灰、烧碱均可用于制取氨气
NH4++OH-,只要能产生OH-的物质都可以使平衡向逆向移动生成NH3,故碱石灰、生石灰、烧碱均可用于制取氨气(3)、B为氨气的干燥装置,氨气为碱性,可以使用碱石灰做干燥剂,故选装置Ⅰ。E用于除去Cl2中混有的HCl气体,D为干燥Cl2的装置分别用Ⅱ Ⅲ
(4)、要检验氯化铵分别检验NH4+和Cl-即可
(5)、尾气中的Cl2会污染环境,可用NaOH溶液吸收
点评:本题属于探究题,但其实质还是对基本的实验知识点的考查,反应原理和物质的性质是其制取装置,干杂、除杂装置的选择依据。因此,对实验基础知识的把握很重要。

练习册系列答案
相关题目