题目内容
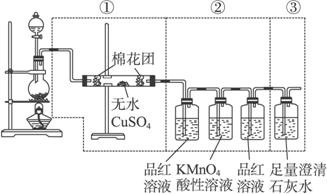
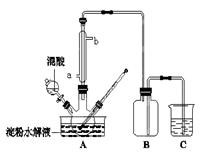
(14分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
Ⅰ.若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
II.若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液)。
(1)写出C中发生反应的化学方程式 。
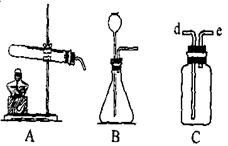
(2)D装置中用氢氧化钠溶液来吸收SO2,为了防止倒吸,应该选用下列装置中的 (填序号)。

请回答下列问题:
Ⅰ.若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
| 装置 | A | B | C | D |
| 试剂 | FeCl2溶液 | 淀粉KI溶液 | 石蕊溶液 | |
| 现象 | 溶液由浅绿色变为棕黄色 | | | |
| 离子方程式 | | | | |
| 装置 | A | B | C |
| 试剂 | 品红溶液 | 酸性高锰酸钾溶液 | 硫化氢的水溶液 |
| 现象 | | 紫色退去 | |
| 体现SO2的性质 | | | 氧化性 |
(2)D装置中用氢氧化钠溶液来吸收SO2,为了防止倒吸,应该选用下列装置中的 (填序号)。
(14分)
(以上表中每空1分)
(1)SO2 + 2H2S ="=3S↓+" 2H2O(2分)
(2)①③(2分)
| 装置 | A | B | C | D |
| 试剂 | | | | NaOH溶液 |
| 现象 | | 溶液变蓝 | 先变红后退色 | |
| 离子方程式 | Cl2+ 2Fe2+ = 2Fe3+ +2Cl- | Cl2+2I-=I2 +2Cl- | | Cl2+2OH-= Cl- +ClO-+2H2O |
| 装置 | A | B | C |
| 试剂 | | | |
| 现象 | 红色退去 | | 生产淡黄色沉淀 |
| 体现SO2的性质 | 漂白性 | 还原性 | |
(1)SO2 + 2H2S ="=3S↓+" 2H2O(2分)
(2)①③(2分)
试题分析:若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液;氯气和氯化亚铁反应生成氯化铁;和碘化钾反应生成碘单质;会使石蕊先变红后褪色;尾气要用氢氧化钠来吸收。若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液),品红会褪色,酸性高锰酸钾也会褪色;氢硫酸会生成黄色沉淀。
点评:氯气和二氧化硫的性质中需要特别注意的是:氯气溶于水后生成的次氯酸具有强氧化性,会使有色物质褪色后不再恢复;二氧化硫是化合性的漂白剂,使物质褪色后还能恢复。

练习册系列答案
相关题目