题目内容
(18分)现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。
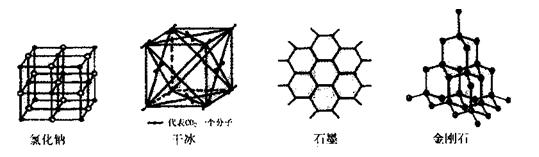
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
(1)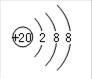 (2分)
(2分)  (2分)
(2分)
(2)SiO2 + 2C Si + 2CO↑(2分)
Si + 2CO↑(2分)
(3)Na2O2(2分) CaC2 2分) CaC2 + 2H2O → Ca(OH)2 + C2H2↑ (2分)
(4)CH4(g)+ 2 O2(g) CO2(g) + 2H2O(l);△H=-820 kJ·mol-1 (3分)
CO2(g) + 2H2O(l);△H=-820 kJ·mol-1 (3分)
(5)A B C (3分)
 (2分)
(2分)  (2分)
(2分)(2)SiO2 + 2C
 Si + 2CO↑(2分)
Si + 2CO↑(2分)(3)Na2O2(2分) CaC2 2分) CaC2 + 2H2O → Ca(OH)2 + C2H2↑ (2分)
(4)CH4(g)+ 2 O2(g)
 CO2(g) + 2H2O(l);△H=-820 kJ·mol-1 (3分)
CO2(g) + 2H2O(l);△H=-820 kJ·mol-1 (3分)(5)A B C (3分)
周期表中前20号元素是一个重要信息,一般都含有钾、钙。化合物种类最多的是烃类,因此A为氢元素、B为碳元素;一氧化碳的电子数为14、二氧化碳的电子数为22,确定C为氧元素;短周期中原子半径最大的为钠元素;硅元素在地壳中含量居第二位;钙是组成人体骨骼和牙齿的主要元素。工业上在高温条件下用碳与二氧化硅反应得到硅单质;碳化钙和过氧化钠中既含有离子键又含有非极性键,前者与水发生非氧化还原反应生成乙炔气体,后者与水发生氧化还原反应生成氢气。

练习册系列答案
相关题目
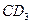 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则: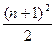 或
或 ,n=1,2,3……;②各周期中元素的种类数都是偶数)( )
,n=1,2,3……;②各周期中元素的种类数都是偶数)( )


