题目内容
(13分)现有前四周期的地五种主族元素A、B、C、D、E,A的最高价氧化物含A40%,A原子质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成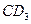 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
(1)五种元素的元素符号分别为
A、 B、 C、 D、 E、
(2)五种元素中,单质还原性最强的是 ,简单例子还原性最强的是
(3)A到E五种元素中最高价氧化物对应的水化物中,酸性最强的是 碱性最强的是
(4)D单质与B的最高价氧化物对应的水化物的反应的离子方程式为
(5)B、C元素最高价氧化物的水化物之间的化学方程式为
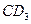 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:(1)五种元素的元素符号分别为
A、 B、 C、 D、 E、
(2)五种元素中,单质还原性最强的是 ,简单例子还原性最强的是
(3)A到E五种元素中最高价氧化物对应的水化物中,酸性最强的是 碱性最强的是
(4)D单质与B的最高价氧化物对应的水化物的反应的离子方程式为
(5)B、C元素最高价氧化物的水化物之间的化学方程式为
(1)S、K、Al、Cl、Mg(2)钾、S2-(3)高氯酸、氢氧化钾(4)Cl2+2OH-=Cl-+ClO-+H2O;(5)Al(OH)3+KOH===KAlO2+2H2O
本题考查原子结构、元素周期律知识;A原子的质子数等于中子数,且最高价氧化物含A为40%,可确定A为硫元素;B在同周期中原子半径最大,为碱金属,B与D形成BD型离子化合物,D为卤族元素,B、D离子电子层结构相同,B原子在D的下一个周期,D比A多一个质子,则D为氯元素,B为钾元素;C与D形成CD3化合物,则C在第IIIA族,由C与硫酸反应的量的关系,可确定C为铝元素,C原子比E原子多一个电子,则E为镁元素。五种元素中,单质还原性最强的为碱金属钾,离子还原性最强的为S2-;最高价氧化物对应水化物酸性最强的在周期表右、上,为高氯酸,最高价氧化物对应水化物碱性最线的在周期表左、下,为氢氧化钾;氯气与氢氧化钾反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O; 氢氧化铝为两性氢氧化物,可与强酸和强碱反应,其与氢氧化钾反应的离子方程式为:Al(OH)3+KOH===KAlO2+2H2O。

练习册系列答案
相关题目