题目内容
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
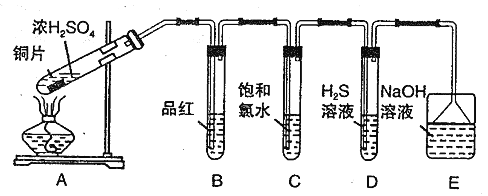
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
【答案】 SO2+Cl2+2H2O=4H++ SO42﹣+2 Cl﹣ 装置C挥发出的氯气也可以使D装置中出现浑浊 尾气处理,防倒吸 Fe2+ 取少量溶液,向其中滴加K3[Fe(CN)3]溶液,若产生蓝色沉淀,则证明原溶液中含有Fe2+(其他合理答案均给分) 酸式滴定管 滴入最后一滴KHC2O4标准液,锥形瓶内溶液由紫色变为无色,且半分钟颜色不恢复 90%
【解析】(1)铜与浓硫酸反应的方程式为2H2SO4(浓) + Cu![]() CuSO4 + 2H2O +SO2↑,二氧化硫能够使品红褪色,二氧化硫具有还原性,能够被饱和的氯水氧化,二氧化硫具有氧化性,能够将硫化氢氧化,C中反应的离子方程式为SO2+Cl2+2H2O=4H++ SO42﹣+2 Cl﹣,故答案为:SO2+Cl2+2H2O=4H++ SO42﹣+2 Cl﹣;
CuSO4 + 2H2O +SO2↑,二氧化硫能够使品红褪色,二氧化硫具有还原性,能够被饱和的氯水氧化,二氧化硫具有氧化性,能够将硫化氢氧化,C中反应的离子方程式为SO2+Cl2+2H2O=4H++ SO42﹣+2 Cl﹣,故答案为:SO2+Cl2+2H2O=4H++ SO42﹣+2 Cl﹣;
(2)由于氯水具有挥发性,C中挥发出的氯气也可以使D装置中出现浑浊,因此D中有浑浊出现,不能证明SO2具有氧化性,故答案为:装置C挥发出的氯气也可以使D装置中出现浑浊;
(3)二氧化硫能够污染空气,E装置中的氢氧化钠能够吸收尾气,防止污染,同时倒扣的漏斗可以防倒吸,故答案为:尾气处理,防倒吸;
(4)还原铁粉与浓硫酸反应的产物中含有二氧化硫和氢气,说明反应一段时间后浓硫酸变成了稀硫酸,发生了铁与稀硫酸的反应,因此溶液X中含有的金属阳离子为Fe2+,检验亚铁离子可以取少量溶液,向其中滴加K3[Fe(CN)3]溶液,若产生蓝色沉淀,则证明原溶液中含有Fe2+,故答案为:Fe2+;取少量溶液,向其中滴加K3[Fe(CN)3]溶液,若产生蓝色沉淀,则证明原溶液中含有Fe2+;
(5)①已知室温下,0.1000mol/L KHC2O4的溶液中,c(C2O42-)>c(H2C2O4),说明电离程度大于水解程度,溶液显酸性,应该选用酸式滴定管盛装KHC2O4溶液;KHC2O4溶液能够被酸性高锰酸钾溶液氧化,滴入最后一滴KHC2O4标准液,锥形瓶内溶液由紫色变为无色,且半分钟颜色不恢复,证明达到了滴定终点,故答案为:酸式滴定管;滴入最后一滴KHC2O4标准液,锥形瓶内溶液由紫色变为无色,且半分钟颜色不恢复;
②气体Y中的二氧化硫被高锰酸钾吸收,剩余的高锰酸钾用KHC2O4溶液滴定。消耗的KHC2O4的物质的量=0.1000mol/L×0.01L=0.001mol,根据2MnO4-+5HC2O4-+11H+=2Mn2++10CO2↑+8H2O,5SO2+ 2 MnO4- + 2 H2O = 2 Mn2+ + 4 H+ + 5 SO42-,可知二氧化硫的物质的量=![]() ×(0.2000mol/L×0.2L-0.001mol×
×(0.2000mol/L×0.2L-0.001mol×![]() ×
×![]() )=0.09mol,
)=0.09mol,
则气体Y中SO2的物质的量分数=![]() ×100%=90%,故答案为:90%。
×100%=90%,故答案为:90%。