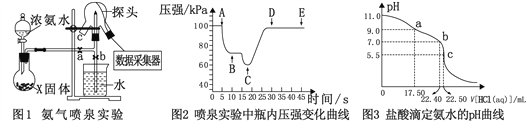
题目内容
【题目】25℃时,在密闭容器中合成氨反应如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的2倍,v(正)减小,v(逆)增大,平衡向左移动
C. 1mol N2(g)和3 mol H2(g)的总键能大于2 mol NH3(g)的总键能
D. 在密闭容器中通入1mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
【答案】D
【解析】A.该反应前后气体的质量始终不变,因此混合气体的质量不变,不能说明该反应是否达到平衡状态,故A错误;B. 将容器的体积扩大到原来的2倍,容器中气体的压强减小,平衡逆向移动,v(正)减小,v(逆)减小,故B错误;C. 该反应为放热反应,说明1molN2(g)和3molH2(g)的总键能小于2molNH3(g)的总键能,故C错误;D. 该反应为可逆反应,在密闭容器中通入1molN2和3molH2进行反应,不可能完全反应,反应放出的热量一定小于92.4kJ,故D正确;故选D。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目