题目内容
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: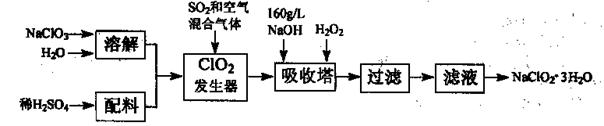
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2—3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 。
吸收塔内的温度不宜过高,否则会发生反应,其方程式为: 。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__ __。
(4)ClO2和氯气均能将电镀废水中的CN—氧化为无毒物质,自身被还原为Cl—,处理含CN一相同量的电镀废水所需氯气的物质的量是ClO2的 倍。
(1)稀释C1O2以防止爆炸(3分)
(2)2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2↑(3分) 2H2O2 2H2O+O2↑(3分)
(3)连续测定吸收塔内溶液的pH(3分)
(4)2.5(3分)
解析试题分析:(1)信息指出纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,所以鼓入空气的作用是稀释C1O2以防止爆炸;(2)双氧水不稳定受热分解,所以吸收塔中温度不宜过高;(3)连续测定吸收塔内溶液的pH;根据电子守恒计算,1molC12得到电子数为2mol,1molC1O2需得到5mol电子,故处理含CN一相同量的电镀废水所需氯气的物质的量是ClO2的2.5倍。
考点:考查化工流程中操作目的、原理、检验及计算等有关问题。

由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下: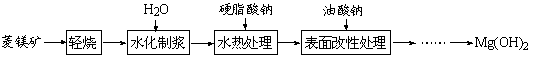
(1)从下面两图可以得出的结论为 、 。
图1 25℃时MgO水化随时间变化X射线衍射谱图 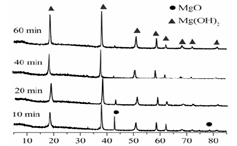
图2 90℃时MgO水化随时间变化X射线衍射谱图
(2)水化反应MgO+H2O = Mg(OH)2能自发进行的原因是 。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有 。(写一条即可)
表1 部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
(4)已知热化学方程式:Mg(OH)2 (s) =" MgO" (s)+H2O (g) ΔH =" 81.5" kJ·mol-1
①Mg(OH)2起阻燃作用的主要原因是 。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是 。
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下: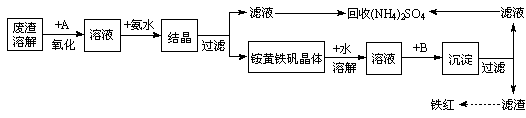
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用 (填序号)
| A.空气 | B.Cl2 | C.MnO2 | D.H2O2, |
③写出A参与反应的离子方程式为__________________________________________
(3根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________________。

(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:_______________________________________________________。
(5)写出铵黄铁矾晶体溶于适量蒸馏水中,往其中加入过量Ba(OH)2溶液,发生反应的离子方程式为:_____________________________________________________
(6)回收所得的(NH4)2SO4晶体可能含有的杂质是:___________________________
[化学-选修化学与技术](15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:
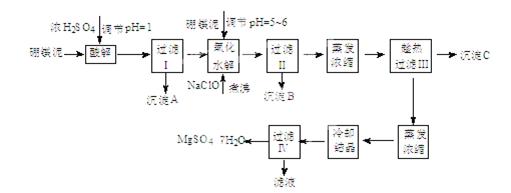
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是( )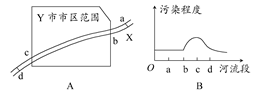
| A.造成X河污染的主要污染源最可能分布在bc段 |
| B.工业生活污水、固体废弃物等可能是造成X河污染的污染源 |
| C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致 |
| D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理 |
下列化学肥料均属于复合肥料的是( )。
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
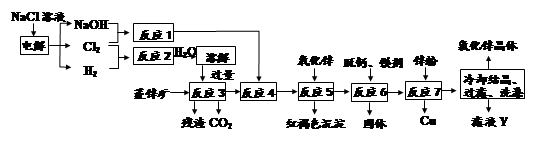
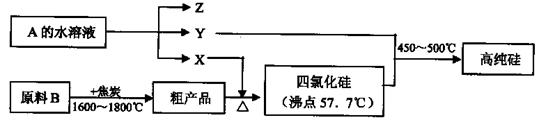
 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。