题目内容
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)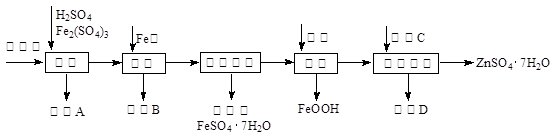
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
(16分)
(1)S(2分)
(2)做氧化剂(2分) Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S↓(3分)
(3)4Fe2++O2+6H2O=4FeOOH+8H+(3分)
增大空气与溶液的接触面积,加快反应速率(2分)
(4)Zn(锌)(2分) (5)60℃条件下蒸发浓缩、降温结晶(2分)
解析试题分析:(1)闪锌矿组成元素中只有硫、氧两种非金属元素,氧气是无色非金属单质,硫黄是黄色非金属单质,则滤渣A的主要成分是S;(2)浸取时,金属硫化物中硫元素由—2升为0价,则金属硫化物是还原剂,由此推导出硫酸铁中铁元素由+3降为+2价,即硫酸铁是氧化剂;硫化锌与硫酸铁反应生成硫酸亚铁、硫酸锌、硫黄,根据最小公倍数法配平,则Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S↓;(3)浓缩结晶的母液含有饱和硫酸亚铁溶液,亚铁离子被氧化为FeOOH时,铁元素化合价由+2升为+3,则空气中氧气是氧化剂,氧元素由0降为—2价,根据电子、电荷、原子守恒原理配平,则该反应为4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置,目的是增大空气与溶液的接触面积,加快反应速率;(4)根据置换反应原理,应选择比Cd活泼的金属,根据除杂原则,除去Cd2+的同时只能引入Zn2+,不能引入别的金属阳离子,因此物质C为锌(Zn);(5)读表可知,0~100℃,硫酸锌的溶解度先随温度升高而增大,后随温度升高而减小,或者60℃左右硫酸锌的溶解度最大,因此在60℃左右蒸发浓缩、冷却结晶、过滤、干燥,可以制备硫酸锌晶体。
考点:考查物质制备工艺流程,涉及硫黄的物理性质、氧化还原反应、化学方程式、离子方程式、影响化学反应速率的因素、除杂试剂的选择、溶解度表、晶体制备方法和原理等。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案[化学-选修化学与技术](15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
| | SrSO4 | BaSO4 | Sr(OH)2 |
| Ksp | 3.3×10—7 | 1.1×10—10 | 3.2×10—4 |
城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是( )
| A.造成X河污染的主要污染源最可能分布在bc段 |
| B.工业生活污水、固体废弃物等可能是造成X河污染的污染源 |
| C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致 |
| D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理 |
化学工业在经济发展中的作用举足轻重。下列有关工业生产的叙述中,正确的是 ( )
| A.硫酸生产中常采用高压条件来提高SO2的转化率 |
| B.合成氨中采用及时分离液态氨来提高反应速率 |
| C.电解精炼铜中,溶液中c(Cu2+)基本保持不变 |
| D.氯碱工业中阳极得到氢氧化钠和氢气 |

 Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
 2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)