题目内容
19.下列各种观点正确的是( )| A. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲苯中含有碳碳双键 | |
| B. | 乙烯能发生加成反应,因而乙烯能在一定条件下聚合生成高分子化合物 | |
| C. | 有机物的水溶液一定不能导电 | |
| D. | 通常情况下呈气态的烃含有的碳原子一定不多于四个 |
分析 A、甲苯、醇等能使酸性高锰酸钾褪色,甲苯、醇中不含碳碳双键或者碳碳三键;
B、乙烯中含有碳碳双键,据此解答即可;
C、羧酸类物质属于酸,在水溶液中电离出氢离子,能导电;
D、通常情况下,C原子数小于或等于4的烃为气体状态.
解答 解:A、甲苯、醇等能使酸性高锰酸钾褪色,甲苯、醇中不含碳碳双键或者碳碳三键,故A错误;
B、乙烯中含有碳碳双键,能发生加成反应,故B正确;
C、羧酸类物质属于酸,在水溶液中电离出氢离子,能导电,故C错误;
D、通常情况下,C原子数小于或等于4的烃为气体状态,碳原子数为5的新戊烷常温下为气体,故D错误,故选B.
点评 本题主要考查的是常见有机化合物的结构与性质,难度不大,注意甲苯能使高锰酸钾溶液褪色的原理是难点.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
9.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:
(1)通过分析 x 值变化规律,确定N、Mg的 x 值范围:
2.55<x (N)<3.44,0.93<x (Mg)<1.57.
(2)某有机化合物结构中含S-N键,其共用电子对偏向氮(写原子名称).
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是共价键.
(4)预测周期表中,x值最小的元素位于六周期IA族.(放射性元素除外)
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
2.55<x (N)<3.44,0.93<x (Mg)<1.57.
(2)某有机化合物结构中含S-N键,其共用电子对偏向氮(写原子名称).
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是共价键.
(4)预测周期表中,x值最小的元素位于六周期IA族.(放射性元素除外)
4.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 氯化铵与乙醇分别受热变为气体 | B. | 氯化钠与氯化氢分别溶解在水中 | ||
| C. | 碘与干冰分别受热变为气体 | D. | NaHSO4受热熔化与溶于水变为溶液 |
11.一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g)?C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体的密度
②容器内气体的压强
③混合气体总物质的量
④B物质的量浓度.
①混合气体的密度
②容器内气体的压强
③混合气体总物质的量
④B物质的量浓度.
| A. | ①④ | B. | 只有②③ | C. | ②③④ | D. | 只有④ |
9.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,如CH3Br+OH-(或NaOH)→CH3OH+Br-(或NaBr),下列化学方程式中不正确的是( )
| A. | CH3CH2Br+NaHS→CH3CH2SH+NaBr | |
| B. | CH3I+CH3ONa→CH3OCH3+NaI | |
| C. | CH3CH2Cl+CH3ONa→CH3CH2ONa+CH3Cl | |
| D. | CH3CH2Cl+CH3CH2ONa→(CH3CH2)2O+NaCl |
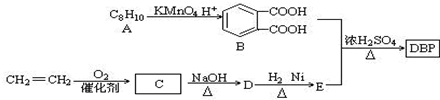
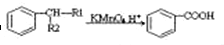
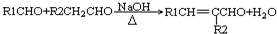 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)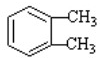 ,D的结构简式是CH3CH=CHCHO,D→E的反应类型加成(还原)反应;
,D的结构简式是CH3CH=CHCHO,D→E的反应类型加成(还原)反应;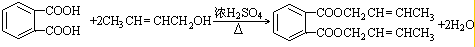 ;
;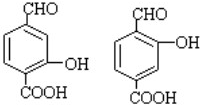 ;
;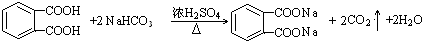 .
.
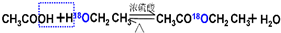 .
.
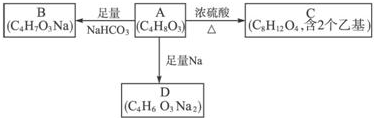
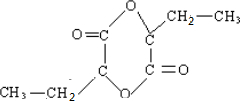 .
.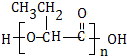 .
.