题目内容
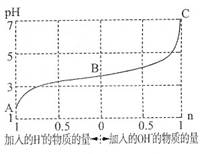
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
| 酸 | 电离平衡常数 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.25℃,等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3
B.少量的SO2通入NaClO溶液中反应的离子方程式为:SO2 + H2O + 2ClO—
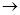 SO32— + 2HClO
SO32— + 2HClOC.少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2 + H2O + ClO—
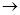 HCO3— + HClO
HCO3— + HClOD.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
CD
解析试题分析:在相同温度下,酸的电离平衡常数越小,其相应的盐水解程度越大,溶液的碱性就越强,即pH越大。若盐溶液的pH相同,则电离平衡常数大的相应的盐浓度大,电离平衡常数小的相应的盐浓度小。A.电离平衡常数HCO3-< HSO3-<HClO<CH3COOH。所以等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量浓度最小的是Na2CO3。但是浓度小,物质的量不一定小。错误。B. SO2有还原性,NaClO有氧化性,二者发生氧化还原反应。反应方程式为:SO2 + H2O + ClO—=SO42— + 2H++Cl-。错误。C.少量CO2通入Ca(ClO)2溶液中,由于酸性H2CO3>HClO> HCO3-。根据强酸制取弱酸的性质。反应的离子方程式为: CO2 + H2O + ClO—= HCO3— + HClO。正确。D.若温度不变,向pH=a的醋酸溶液中加一定量水,若原来是稀溶液,稀释作用大于平衡正向移动是c(H+)增大的趋势,所得溶液的pH>a;若原来是浓溶液,加水时使酸分子的电离作用大于水的稀释作用,平衡正向移动是c(H+)增大的趋势,所得溶液的pH<a;若加水时使酸分子的电离作用等于加水对溶液的稀释作用,平衡不发生移动pH=a。故三种情况均有可能。正确。
考点:考查电离平衡常数在比较离子浓度、溶液的酸碱性、化学反应中的应用的知识。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案实验:① 将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
② 取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;
③ 将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色;
④ 另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中,不正确的是:
| A.将①中所得浊液过滤,所得滤液中含少量Mg2+ |
B.浊液中存在溶解平衡:Mg(OH)2(s)  Mg2+(aq) + 2OH-(aq) Mg2+(aq) + 2OH-(aq) |
| C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶 |
| D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因 |
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:
Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,
 减小
减小 甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1 |
| B.甲酸能与水以任意比互溶 |
| C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 |
| D.滴入石蕊试液显红色 |
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
| A.溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的Ksp的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀 |
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是 ( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2mol>沉淀的物质的量>0 |
| C.沉淀的质量=49a g |
| D.溶液中n(SO42—)=a/2 mol |
下列说法正确的是 ( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |