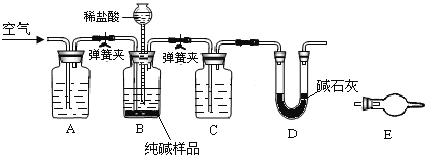
题目内容
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
【答案】)第3周期、第ⅥA族 Al>C>N ![]() N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
【解析】
图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,Q是C,R是N,W是S,据此解答各小题即可。
T所处的周期序数与主族族序数相等,则T为Al,结合位置可知:Q是C,R是N,W是S,
(1)W为S,S有3个电子层,最外层6个电子,故处于第三周期ⅥA族,电子层数越多,半径越大,同一周期原子序数越小,半径越大,故C、N、Al三种元素原子的半径从大到小排列顺序Al>C>N,C的最高价氧化物为二氧化碳,CO2中C与O形成两对共价键,故电子式为![]() ,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;
,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;![]() ;N2O5;
;N2O5;
(2)T为Al,与氢氧化钠反应的离子方程式为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑。

【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去),请回答下列问题:
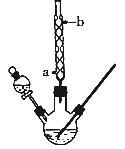
(1)球形冷凝管的作用是____________,冷凝水从____________(填“a”或“b”)处进入。
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
溶点/℃ | 117.3 | 16.6 | -83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于____________反应(填字母)。
a.加成反应 b.取代反应 c.酯化反应 d.消去反应
②考虑到反应速率等多种因素.用上述装置制备乙酸乙酯时,反应的最佳温度范围是____________(填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)反应结束后,欲从反应混合物中分离出乙酸乙酯,应使用的分离方法是____________(填操作方法名称,下同),所用到的主要仪器为____________,进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用____________的方法:在乙酸乙酯的同类物质的同分异构体中,有一种直链的酯在强碱条件下与新制氢氧化铜浊液混合加热一段时间后,发现生成了砖红色沉淀,请写出的化学方程式________________________。
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g.则乙酸乙酯的产率是____________。
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式______________________。
【题目】下列关于物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 纯碱 | 硫酸 | 小苏打 | 氧化铝 | 干冰 |
B | 苛性钠 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
C | 熟石灰 | 冰醋酸(CH3COOH) | 胆矾CuSO4·5H2O | 三氧化硫 | 二氧化硫 |
D | 苛性钾 | HNO3 | 碳酸钙 | 生石灰 | SO3 |
A.AB.BC.CD.D