题目内容
【题目】利用H2S废气制取H2的方法有利于环保。
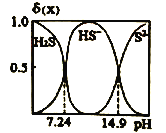
(l) H2S的电子式是____,H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图所示,H2S的电离平衡常数ka1= ___________
![]()
(2)利用H2S废气制取H2的方法有多种。
①热化学硫碘循环法 已知循环反应如下:
H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol
SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol
2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
写出硫化氢气体分解为氢气和固体硫的热化学方程式_____。
②高温热分解法
已知:H2S (g) =H2(g)+l/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol/L,测定H2S的转化率,H2S的平衡转化率与温度关系如图所示。据图可知:温度升高平衡常数K_______(填“增大”、“减小”或“不变”)。若985℃时平衡常数K=0.04,则起始浓度c= ______mol/L 。
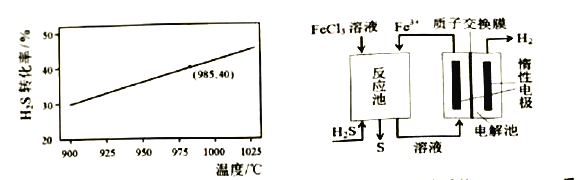
③电化学法 该法制氢过程的示意图如上图。循环利用的物质是____。反应池中化学反应方程式为______。电解池阳极电极反应式为____ 。
【答案】 ![]() 10-7.24 H2S(g)==H2(g)+S(s) ΔH=20KJ·mol-1 增大 0.018 ③FeCl3 2FeCl3+H2S==2FeCl2+S↓+2HCl Fe2+-e-==Fe3+
10-7.24 H2S(g)==H2(g)+S(s) ΔH=20KJ·mol-1 增大 0.018 ③FeCl3 2FeCl3+H2S==2FeCl2+S↓+2HCl Fe2+-e-==Fe3+
【解析】 (1) H2S的电子式为![]() ,根据H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化图,当pH=7.24时,c(H2S )= c(HS-),则H2S 的电离平衡常数ka1=
,根据H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化图,当pH=7.24时,c(H2S )= c(HS-),则H2S 的电离平衡常数ka1=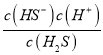 = c(H+)=10-7.24,故答案为:
= c(H+)=10-7.24,故答案为:![]() ;10-7.24;
;10-7.24;
(2) ①i.H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol,ii.SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol,iii.2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
根据盖斯定律,将i+ii+iii得,H2S(g)==H2(g)+S(s) ΔH=20kJ·mol-1,故答案为:H2S(g)=H2(g)+S(s) ΔH=20 kJ/mol;
②据图可知:温度升高,H2S的平衡转化率增大,平衡正向移动,平衡常数K增大。985℃时,H2S的平衡转化率为40%,起始浓度H2S的浓度为c mol/L,则平衡时c(H2S)=0.6c mol/L,c(H2)=0.4c mol/L,c(S2)=0.2c mol/L,则K=0.04=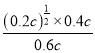 ,解得c=0.018,故答案为:增大;0.018;
,解得c=0.018,故答案为:增大;0.018;
③根据装置图,硫化氢与氯化铁在反应池中发生2FeCl3+H2S=2FeCl2+S↓+2HCl,反应生成的亚铁离子在电解池中被氧化生成铁离子,参与循环利用,电解池阳极电极反应式为Fe2+-e-=Fe3+,故答案为:FeCl3;2FeCl3+H2S==2FeCl2+S↓+2HCl;Fe2+-e-=Fe3+。

【题目】已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣5 akJmol﹣1则O﹣H的键能为( )
共价健 | N﹣N | N﹣H | O=O | N≡N |
键能kJmol﹣1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol﹣1
B.2.5a kJmol﹣1
C.3a kJmol﹣1
D.3.5a kJmol﹣1
【题目】根据电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO | H2SO3 |
电离平衡常数(Ka) | Ka=7.2×10-4 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ka1=1.0×10-2 Ka2=5.0×10-8 |
(1)25℃时,同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是____________(写化学式)。
(2)将0.1mol·L-1的HF溶液1mL加水稀释至10mL(假设温度不变),下列各量增大的是___________(填写字母)。
A.c(H+) B.c(H+)·c(OH-) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(3)25℃时,现有物质的量浓度均为0.1mol·L-1的下列四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。
依据数据判断其pH由大到小的顺序是_________________________(填写序号)。
(4)根据H2SO3的电离平衡常数,计算25℃时,0.05mol·L-1Na2SO3溶液的pH=__________。
若某Na2SO3和NaHSO3的混合液呈中性,则溶液中c(SO32-)__________c(HSO3-)(填“大于”、“小于“或“等于")。