题目内容
【题目】干燥的二氧化碳和氨气反应可生成氨基甲酸铵固体,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

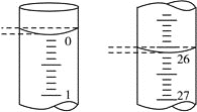
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____________,装置2中所加试剂为__________________;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为___________,试管口不能向上倾斜的原因是________,装置3中试剂为KOH,其作用为___________;
(3)反应时,三颈烧瓶需用冷水浴冷却,其目的是___________________。
(4)下列实验事实能说明N的非金属性比C的非金属性强的是______________
A. 酸性:HNO3>H2CO3
B. NH3的沸点高于CH4
C. NH3在水中的溶解性大于CH4在水中的
【答案】稀盐酸 浓H2SO4 2NH4Cl +Ca(OH)2![]() 2NH3↑+ CaCl2 +2H2O 冷凝水倒流到试管底部使试管破裂 干燥剂(干燥氨气) 降低温度,使平衡正向移动提高产量 A
2NH3↑+ CaCl2 +2H2O 冷凝水倒流到试管底部使试管破裂 干燥剂(干燥氨气) 降低温度,使平衡正向移动提高产量 A
【解析】
(1)用碳酸钙与稀盐酸反应生成二氧化碳气体,用浓硫酸干燥二氧化碳气体;
(2)实验室用固体NH4Cl和Ca(OH)2在加热的条件下制取氨气,KOH能够干燥氨气;
(3)该反应为放热反应,降低温度平衡向着正向移动;
(4)判断元素非金属性强弱的依据有:单质与氢气化合的难易,气态氢化物的稳定性,最高价氧化物对应水化物的酸性以及单质之间的置换反应等。
(1)装置1用来制备二氧化碳气体,将块状石灰石放置在试管中的带孔塑料板上,碳酸钙与稀盐酸反应生成二氧化碳气体,则漏斗中盛放的试剂为稀盐酸;装置2中的试剂用于干燥二氧化碳,应盛放浓硫酸,故答案为:稀盐酸;浓H2SO4;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为:2NH4Cl +Ca(OH)2![]() 2NH3↑+ CaCl2 +2H2O,该反应中有水生成,且在加热条件下进行,若试管口向上倾斜,冷凝水会倒流到试管底部使试管破裂,则试管口不能向上倾斜;装置3中KOH为干燥剂,能够干燥氨气,故答案为:2NH4Cl +Ca(OH)2
2NH3↑+ CaCl2 +2H2O,该反应中有水生成,且在加热条件下进行,若试管口向上倾斜,冷凝水会倒流到试管底部使试管破裂,则试管口不能向上倾斜;装置3中KOH为干燥剂,能够干燥氨气,故答案为:2NH4Cl +Ca(OH)2![]() 2NH3↑+ CaCl2 +2H2O;冷凝水倒流到管底部使试管破裂;干燥剂(干燥氨气);
2NH3↑+ CaCl2 +2H2O;冷凝水倒流到管底部使试管破裂;干燥剂(干燥氨气);
(3)反应2NH3(g)+CO2(g)NH2COONH4(s))的△H<0,为放热反应,降低温度平衡向着正向移动,可提高产量,所以反应时三颈烧瓶需用冷水浴冷却,故答案为:降低温度,使平衡正向移动提高产量;
(4)A. 最高价氧化物对应水化物的酸性越强,其非金属性越强,HNO3、H2CO3分别为N、C的最高价氧化物对应的水化物,酸性: HNO3>H2CO3,可以说明N的非金属性比C的非金属性强,故A符合;
B. NH3的沸点高于CH4,与氢键、分子间作用力有关,与非金属性强弱无关,故B不符合;
C. NH3在水中的溶解性大于CH4在水中的,与物质的溶解性有关,与非金属性强弱无关,故C不符合,故答案为:A。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案