��Ŀ����
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�
(1)�ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��________��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����________Ϊֹ��
(2)���в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵�����____����
A ��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B �ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C ��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D ��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
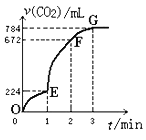
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ________mL���յ����Ϊ________mL������������Һ�����Ϊ________mL��
(4)ijѧ������3��ʵ��ֱ��¼�й����������
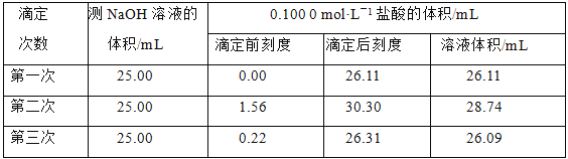
�����ϱ�������ʽ�����NaOH��Һ�����ʵ���Ũ��_______________��
���𰸡���ƿ����ɫ�仯 ������ڲ���ɫ D 0.00 26.10 26.10 0.1044 mol��L��1
��������
(1)�����к͵ζ��ļ��㹫ʽ��c(HCl)V(HCl)=c(NaOH)V(NaOH)���ñ�������ζ������NaOH��Һʱ���ζ�ǰ�豣֤c(HCl)��c(NaOH)��V(NaOH)��ȷ���ζ�ʱ��Ҫȷ��V(HCl)��ȷ�����Եζ��յ��ȷ���ܹؼ����ɴ˿�֪���۾���ע�����ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����ά��һ��ʱ��Ϊֹ��
(2)A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��Ȼ�������Ũ�ȼ�С���������ƫ��
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����������n(NaOH)�ı仯��
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����Ȼ��ɶ�ȡ��V(HCl)ƫ��
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ�������Ȼ��ɶ�ȡ��V(HCl)ƫС��
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʱ��Ӧ����С�������λ��
(4)���еڶ���ʵ�飬V(HCl)���������������ƫ��̫��Ӧ����һ��������ʵ������ȡƽ��ֵ�����빫ʽc(HCl)V(HCl)=c(NaOH)V(NaOH)���м��㡣
(1)�ñ�������ζ������NaOH��Һʱ���ζ�ǰ�豣֤c(HCl)��c(NaOH)��V(NaOH)��ȷ���ζ�ʱ��Ҫȷ��V(HCl)��ȷ�����Եζ��������۾�ע����ƿ����ɫ�仯��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����ά�ְ�����ڲ���ɫΪֹ����Ϊ����ƿ����ɫ�仯��������ڲ���ɫ��
(2)���ù�ʽc(NaOH)=![]() ���з�����
�������
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��Ȼ�������Ũ�ȼ�С���������ƫ��c(NaOH)ƫ�ߣ�
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����������n(NaOH)�ı仯�� V(HCl)���䣬c(NaOH)���䣻
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����Ȼ��ɶ�ȡ��V(HCl)ƫ��c(NaOH)ƫ�ߣ�
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ�������Ȼ��ɶ�ȡ��V(HCl)ƫС��c(NaOH)ƫ�͡���Ϊ��D��
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ0.00mL���յ����Ϊ26.10mL������������Һ�����Ϊ26.10mL����Ϊ��0.00��26.10��26.10��
(4)V(HCl)=![]() =26.10mL�� c(NaOH)=
=26.10mL�� c(NaOH)=![]() =
=![]() = 0.1044 mol��L��1������0.1044 mol��L��1��
= 0.1044 mol��L��1������0.1044 mol��L��1��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ2NO��g����O2��g��![]() 2NO2��g����ϵ�У�n��NO����ʱ��仯���±���
2NO2��g����ϵ�У�n��NO����ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____����֪��K��300������K��350��������÷�Ӧ����Ӧ��_________�ȷ�Ӧ�������¶ȣ�����Ӧ����_______������������������С����������������
��2����ͼ�б�ʾNO2�ı仯��������____����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��O2����______��
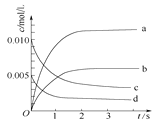
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________��
A��v��NO2����2v��O2�� B��������ѹǿ���ֲ���
C��v����NO����2v����O2�� D���������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
A����ʱ�����NO2���� B���ʵ������¶� C������O2��Ũ�� D��ѡ���Ч����