题目内容
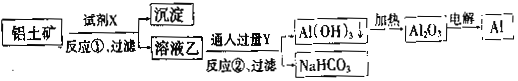
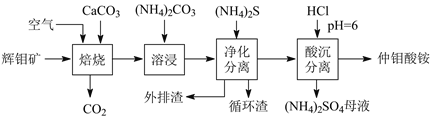
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
【答案】18mol或18NA 6 能耗低,无SO2排放造成的环境污染 CaMoO4+(NH4)2CO3 = (NH4)2MoO4+CaCO3 SiO2 硫酸铵溶液中NH4+水解显酸性,促进CaCO3溶解 H2(或氢气) 9ClO-+MoS2+6OH- = MoO42-+2SO42-+9Cl-+3H2O
【解析】
辉钼矿与碳酸钙混合在空气中焙烧,MoS2转化为CaMoO4和CaSO4,其他杂质元素转化为相应的氧化物,之后溶浸并加入碳酸铵,CaMoO4与(NH4)2CO3发生复分解反应转化为(NH4)2MoO4和碳酸钙,硫酸钙转化为碳酸钙,再加入硫化铵得到杂质金属元素的硫化物沉淀以及SiO2,分离沉淀,其中碳酸钙可循环使用;之后向滤液中加入HCl调节pH为6得到仲钼酸铵沉淀。
(1)MoS2中S为-1价,Mo为+2价,产物CaMoO4和CaSO4中Mo为+6价,S为+6价,MoS2中各元素共升高18价,所以反应中每摩MoS2转移的电子数为18NA;Mo7O24n-中Mo为+6价,O为-2价,所以n=2×24-7×6=6;
(2)传统焙烧温度高,能耗高,产生污染物SO2,图示流程焙烧温度400℃,能耗较低,且无SO2排放造成的环境污染;
(3)溶浸时加入的物质为(NH4)2CO3,根据复分解反应的特点可知方程式应为CaMoO4+(NH4)2CO3 = (NH4)2MoO4+CaCO3;辉钼矿中的杂质元素有Ca、Si、Cu、Zn、Fe等,焙烧时杂质元素生成相应的氧化物,溶浸后Ca最终转化为碳酸钙沉淀,溶浸后又加入硫化铵,所以Cu、Zn、Fe转化为相应的硫化物沉淀,SiO2不溶于酸,所以外排渣主要是SiO2和Cu、Zn、Fe的硫化物;
(4)硫酸铵溶液中NH4+水解显酸性,促进CaCO3溶解,所以在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵;
(5)电解槽无隔膜,所以电解时阴极水电离出的氢离子放电生成氢气;阳极氯离子放电生成氯气,溶液显碱性,氯气反应生成次氯酸根,NaClO氧化MoS2生成MoO42-和SO42-,MoS2整体化合价升高18价,ClO-转化为Cl-降低2价,结合电子守恒和元素守恒可得离子方程式为:9ClO-+MoS2+6OH-= Mo42-+2SO42-+9Cl-+3H2O。

 第1卷单元月考期中期末系列答案
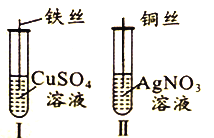
第1卷单元月考期中期末系列答案【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。