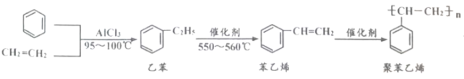
题目内容
【题目】设NA表示阿伏加德罗常数的值。下列说法错误的是
A.3.6 g C60与C50组成的混合物中。含有的电子数目为1.8NA
B.6.72 L(标准状况)Cl2与足量乙烷反应时,断裂的C-H键数目为0.3NA
C.0.1 L浓度均为2 mol/L的(NH4)2SO4、NH4Cl溶液中,NH4+数目前者比后者多0.2 NA
D.0.1 mol H3BO3[电离方程式:H3BO3+H2O![]() H++B(OH)4-]消耗OH-数目最多为0.1 NA
H++B(OH)4-]消耗OH-数目最多为0.1 NA
【答案】C
【解析】
A. C60与C50均是由碳原子组成的,3.6 g碳原子的物质的量n(C)=3.6 g÷12 g/mol=0.3 mol,每个C原子中含有6个电子,则0.3 mol C原子中含有电子数目:0.3 mol ×6NA/mol=1.8NA,A正确;
B. 6.72L(标准状况)Cl2的物质的量n(Cl2)=6.72 L ÷22.4 L/mol=0.3 mol,Cl2与足量的乙烷反应时,有一半的氯原子取代烷烃分子中的氢原子,故反应时断裂的C-H键物质的量为0.3 mol,B正确;
C. 0.1 L浓度为2 mol/L盐溶液中含有溶质的物质的量为n=2 mol/L×0.1 L=0.2 mol,若不考虑盐的水解,NH4+数目前者比后者多0.2NA,但NH4+能水解且水解程度与溶液中c(NH4+)有关,离子浓度越小,水解程度越大,故两种溶液中NH4+数目:前者比后者多的数值大于0.2NA,C错误;
D. 由硼酸电离方程式可知:硼酸为一元酸,所以0.1 mol H3BO3消耗OH-数目最多为0.1 NA,D正确;
故合理选项是C。

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目