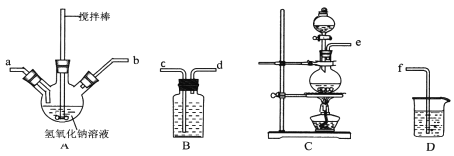
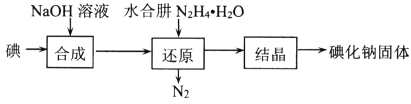
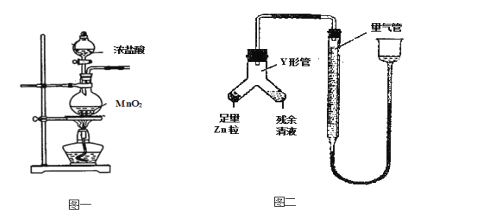
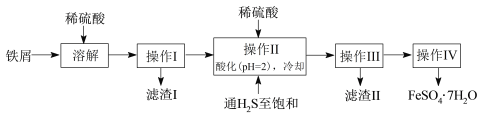
题目内容
【题目】化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:有关下列曲线图的说法正确的是( )
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化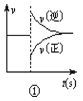
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的硫酸溶液时pH变化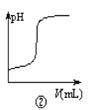
C.曲线图③可以表示向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液时的产生沉淀的物质的量变化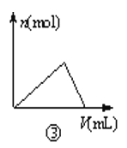
D.曲线图④可以表示所有的固体物质溶解度随温度的变化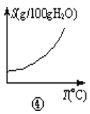
【答案】C
【解析】
A. 图象中改变条件V(逆)增大、v(正)减小,改变温度瞬间正、逆速率都增大,该图不能表示改变温度后反应速率随时间的变化,A错误;
B. 氢氧化钠溶液呈碱性,向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸,溶液pH逐渐减小,图象与实际不相符,图象应为一定量的稀硫酸中滴加一定量氢氧化钠溶液,B错误;
C. 向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+反应完毕,继续滴加NaOH溶液,发生反应OH-+Al(OH)3=AlO2-+2H2O,所以先生成沉淀,再沉淀溶解,根据方程式可知生成沉淀与沉淀溶解阶段消耗NaOH溶液的体积之比为3:1,图象与实际相符合,C正确;
D. 氯化钠溶解度随温度的增大变化不大,氢氧化钙溶解度随温度而降低,D错误;故答案为:C。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。