题目内容
16.下列气体溶于水,发生氧化还原反应的是( )| A. | SO2溶解于水 | B. | CO2溶解于水 | C. | NO2溶解于水 | D. | NH3溶解于水 |
分析 发生的反应中,存在元素的化合价变化,则发生了氧化还原反应,以此来解答.
解答 解:A.二氧化硫溶于水反应生成亚硫酸,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.二氧化碳溶于水反应生成碳酸,没有元素的化合价变化,不发生氧化还原反应,故B不选;
C.二氧化氮溶于水反应生成硝酸和NO,N元素的化合价变化,发生了氧化还原反应,故C选;
D.氨气溶于水反应生成一水合氨,没有元素的化合价变化,不发生氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意酸性氧化物的性质及发生的化学反应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列反应一定属于取代反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CH3CH=CH2+Br2→CH3CHBrCH2Br | ||
| C. | CH4+Br2 $\stackrel{光}{→}$CH3Br+HBr | D. | a-b+c-d═a-c+b-d |
7.下列说法正确的是( )
| A. | 二氧化硅可以用来制造光导纤维 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 粗硅制单晶硅不涉及氧化还原反应 |
4.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
11.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
1.浓硫酸和浓硝酸是实验室常用的酸,下列关于它们的说法错误的是( )
| A. | 浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 | |
| B. | 浓硫酸和浓硝酸都能与金属铜反应 | |
| C. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| D. | 浓硫酸和浓硝酸在常温下都能用金属铝或铁制容器盛放 |
8.假设x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是( )
| A. | ⅠB族 | B. | ⅢB族 | C. | ⅢA族 | D. | ⅡA族 |
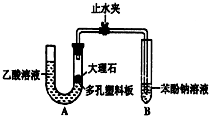 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.