题目内容
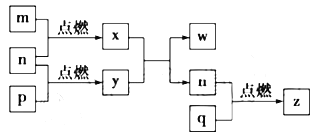
【题目】短周期主族元素a、b、c、d的原子序数依次增大。这四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时, 0.01 mol/L w溶液pH=12。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小:a<b<c<d
B.氢化物的稳定性:b<d
C.y中阴阳离子个数比为1:2
D.等物质的量y、w溶于等体积的水得到物质的量浓度相同的溶液
【答案】C
【解析】
短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,z为SO2,q为S,d为S元素;25℃0.01 mol/Lw溶液pH=12,w为强碱溶液,则w为NaOH,结合原子序数及图中转化可知,a为H,b为O,c为Na,x为H2O,y为Na2O2,以此来解答。
根据上述分析可知:a为H,b为O,c为Na,d为S元素,x为H2O,y为Na2O2,z为SO2。
A.原子核外电子层越多,原子半径越大,同一周期元素从左向右原子半径减小,则原子半径的大小:a<b<d<c,A错误;
B.元素的非金属性:O>S,元素的非金属性越强,其相应的氢化物稳定性就越强,故氢化物的稳定性:H2O>H2S,即b>d,B错误;
C.y为Na2O2,其中含有离子键和非极性共价键,电离产生2个Na+和O22-,所以y中阴、阳离子个数比为1:2,C正确;
D. y是Na2O2,Na2O2溶于水反应产生NaOH和O2,w为NaOH,1 mol Na2O2反应消耗1 mol H2O产生2 mol NaOH,所以等物质的量y、w溶于等体积的水得到的溶液的物质的量浓度不同,D错误;
故合理选项是C。