题目内容
【题目】(1)Fe2+的最外层电子排布式__;基态铜原子的电子排布式为__。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-配离子,则钛元素的化合价是__,配体是__。
(3)TiCl3可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有__;反应中涉及的元素中电负性最大的是__。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__。
,该反应中涉及的物质中碳原子的杂化轨道类型有__;反应中涉及的元素中电负性最大的是__。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__。
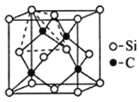
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为__,在SiC中,每个C原子周围最近的C原子数目为__,若晶胞的边长为apm,则金刚砂的密度为__。
【答案】3s23p63d6 [Ar]3d104s1或1s22s22p63s23p63d104s1 +4 F- sp3、sp2 Cl CO2 原子晶体 12 ![]()
【解析】
(1)Fe原子失去最外层2个电子生成Fe2+,其M电子层变为最外层,M电子层上3s、3p、3d能级上分别含有2、8、6个电子;Cu原子核外有29个电子,根据构造原理书写基态Cu原子电子排布式;
(2)F元素的化合价为-1价,该离子的化合价为-2价,据此计算Ti元素化合价;配体是氟离子;
(3)甲基上的C原子价层电子对个数是4、其它两个碳原子价层电子对个数都是3,根据价层电子对互斥理论判断C原子杂化类型;元素的非金属性越强,其电负性越大;该物质燃烧生成氧化铝和二氧化碳、水,立体构型是直线形的是CO2;
(4)原子晶体硬度较大;在SiC中,每个C原子周围最近的C原子个数=3×8÷2;晶胞中C原子个数是4、Si原子个数=8×![]() +6×
+6×![]() =4,晶胞体积=(a×10-10cm)3,晶体密度=
=4,晶胞体积=(a×10-10cm)3,晶体密度=![]() 。
。
(1)Fe原子失去最外层2个电子生成Fe2+,其M电子层变为最外层,M电子层上3s、3p、3d能级上分别含有2、8、6个电子,其最外层电子排布式为3s23p63d6;Cu原子核外有29个电子,根据构造原理书写基态Cu原子电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;
(2)F元素的化合价为1价,该离子的化合价为2价,据此计算Ti元素化合价=2(1)×6=+4;配体是F;
(3)甲基上的C原子价层电子对个数是4、其它两个碳原子价层电子对个数都是3,根据价层电子对互斥理论判断C原子杂化类型分别为sp3、sp2;元素的非金属性越强,其电负性越大,非金属性最强的是Cl元素,则电负性最大的是Cl;该物质燃烧生成氧化铝和二氧化碳、水,立体构型是直线形的是CO2;
(4)原子晶体硬度较大,SiC硬度很大,所以为原子晶体;在SiC中,每个C原子周围最近的C原子个数=3×8÷2=12;晶胞中C原子个数是4、Si原子个数8×![]() +6×
+6×![]() =4,晶胞体积=(a×1010cm)3,晶体密度=
=4,晶胞体积=(a×1010cm)3,晶体密度=![]() =
=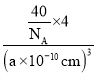 g/cm3=
g/cm3=![]() gcm3。
gcm3。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
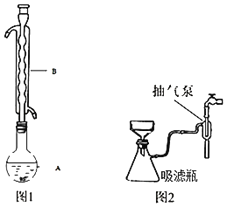
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。