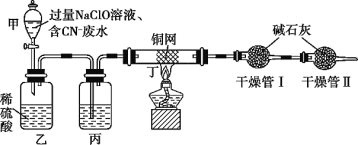
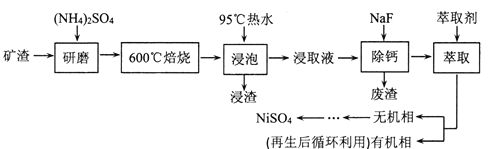
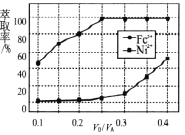
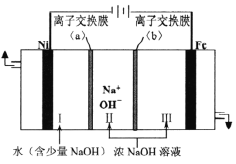
题目内容
【题目】下列说法正确的是( )
A. 对于N2(g) + 3H2(g) ![]() 2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
B. 对某一可逆反应,升高温度则化学平衡常数一定变大
C. 平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D. 改变条件,使反应物的平衡转化率都增大,该可逆反应的平衡常数一定增大
【答案】C
【解析】
A.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,故A错误;
B.对某一可逆反应,可能是吸热反应,也可能是放热反应,升高温度,化学平衡常数可能增大,也可能减小,故B错误;
C.化学平衡常数只与温度有关,平衡常数发生变化,说明温度一定发生变化,化学平衡必定发生移动达到新的平衡,故C正确;
D.改变条件,使反应物的平衡转化率都增大,改变的条件可能是温度,也可能是压强,化学平衡常数只与温度有关,因此平衡常数不一定变化,故D错误;
故选C。

练习册系列答案
相关题目