题目内容
【题目】Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。
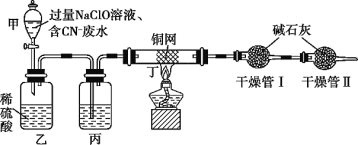
操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为________________;装置乙中反应的离子方程式为________________。
(2)装置丙中的试剂是________________,装置丁的作用是________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为________________。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会________________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________(填方案编号)。
【答案】分液漏斗 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 吸收混合气中的Cl2 80.0% 偏高 部分Cl2在装置丁中没有被吸收而在干燥管Ⅰ中被吸收(或“偏低:部分CO2残留在装置内没有在干燥管Ⅰ中被完全吸收”或“无法确定:部分Cl2在干燥管Ⅰ中被吸收,部分CO2没有在干燥管Ⅰ中被吸收”等合理答案均给分) 方案①
【解析】
(1)装置甲玻璃仪器名称为分液漏斗;装置乙中,CNO-被ClO-在酸性溶液中进一步氧化,生成N2、Cl2和CO2等,反应的离子方程式为2CNO- +6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O。答案为:分液漏斗;2CNO- +6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O;
(2)从实验装置中可以看出,在分液漏斗甲中,过量NaClO与CN-混合,发生反应生成CNO-,将反应后的液体与乙装置内的稀硫酸混合,发生反应生成N2、Cl2和CO2等;从装置丁看,铜网的作用是吸收Cl2,干燥管Ⅰ是吸收CO2,由CO2的质量计算含CN-电镀废水中CN-的质量;干燥管Ⅱ是吸收进入空气中的CO2、H2O等,防止被干燥管Ⅰ吸收,从而引起CO2的质量偏差。由此可推出丙装置中的溶液应能吸收反应生成的水蒸气,所以应加入浓硫酸。装置丁的作用是吸收混合气中的Cl2。答案为:浓硫酸;吸收混合气中的Cl2;
(3)假定上述实验中的气体都被充分吸收,若干燥管Ⅰ增重1.408g,则CN-被处理的百分率为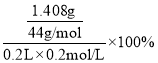 =80.0%。答案为:80.0%;
=80.0%。答案为:80.0%;
(4)用此装置进行实验,难以保证Cl2被丁装置完全吸收,也无法保证生成的CO2被干燥管Ⅰ中的碱石灰完全吸收,所以CN-实际被处理的百分率与(3)中比较会偏高,理由是:部分Cl2在装置丁中没有被吸收而在干燥管Ⅰ中被吸收(或“偏低;部分CO2残留在装置内没有在干燥管Ⅰ中被完全吸收”或“无法确定:部分Cl2在干燥管Ⅰ中被吸收,部分CO2没有在干燥管Ⅰ中被吸收”等合理答案均给分)。
(5)方案①:A中加入少量KMnO4溶液,因为Fe2+、Cl-都能将MnO4-还原,所以溶液紫红色褪去不能证明Fe2+的存在,方案①不合理;
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红,则证明含有Fe2+,方案②合理;
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀,证明溶液中含有SO42-,方案③合理;
上述实验方案中,不合理的是方案①。答案为:方案①。