题目内容
【题目】SO2 是中学化学中的常见气体,也是大气污染物的主要组成成分。回答下列问题:
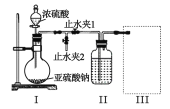
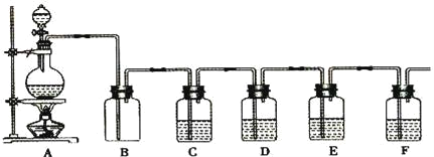
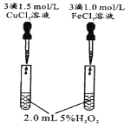
⑴甲组同学利用下列装置制备并收集干燥的 SO2:
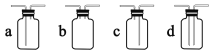
装置Ⅰ中盛装亚硫酸钠的仪器名称是_______,装置 II 的作用是对 SO2 气体进行干燥,该装置中所盛 试剂名称为_________,装置 III 为集气装置,应选取填入 III 中的集气装置为___________(选填字母代号)。
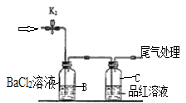
⑵乙组同学利用下列装置制备 SO2 并探究其性质:
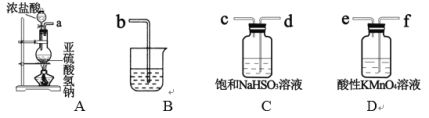
①该组同学的实验装置中,依次连接的合理顺序为a→_________。装置C中饱和NaHSO3溶液的作用是________。
②能证明SO2具有还原性的现象是___________,该反应的离子方程式为_________________。
③装置B的作用吸收SO2尾气,该装置中盛装的试剂是_______________。
⑶设计实验证明H2SO3为弱电解质:________________。
【答案】圆底烧瓶 浓硫酸 a d→c→f→e→b 除去SO2中的HCl 酸性KMnO4溶液褪色 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ NaOH溶液 用pH试纸检验Na2SO3溶液,试纸变蓝或用pH试纸(或pH计)检测0.01mol·L-1 NaHSO3,pH>2
【解析】
(1)根据装置图分析可知,Ⅰ为浓硫酸和亚硫酸钠制取SO2的装置,Ⅱ为干燥SO2的装置,Ⅲ为SO2的收集装置,据此分析解答;
(2)由装置图,A为SO2的制取装置,B为尾气吸收装置,C为除杂装置,可除去SO2中混有的HCl,HCl与饱和的NaHSO3反应生成SO2,可除去SO2中的杂质HCl,D为SO2的还原性检验装置,据此分析解答。
(1)根据装置结构可知,装置Ⅰ中盛装亚硫酸钠的仪器是圆底烧瓶,浓硫酸具有吸水性,且由于SO2是酸性气体,不与浓硫酸反应,故干燥SO2可用浓硫酸,SO2的密度比空气大,因此采用向上排空气法,进气管应插入集气瓶底部,a符合要求,故答案为:圆底烧瓶;浓硫酸;a;
(2)①根据装置图分析可知,A为SO2的制取装置,B为尾气吸收装置,C为除杂装置,可除去SO2中混有的HCl,HCl与饱和的NaHSO3反应生成SO2,可除去SO2中的杂质HCl,D为SO2的还原性检验装置,实验时,装置连接顺序为制取气体装置→除杂装置→性质实验装置→尾气吸收装置,气体在进入呈有相应试剂的集气瓶时应长进短处,则依次连接的合理顺序为a→d→c→f→e→b,故答案为:d→c→f→e→b;除去SO2中的HCl;
②SO2具有还原性,可与酸性高锰酸钾溶液发生氧化还原反应,SO2被MnO4-氧化成SO42-,从而酸性高锰酸钾溶液褪色,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故答案为:酸性KMnO4溶液褪色;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
③SO2为酸性气体,可用NaOH溶液吸收,即装置B中盛装的试剂是NaOH,故答案为:NaOH溶液;
(3)通过检验一定浓度H2SO3溶液的pH或检验亚硫酸盐溶液的酸碱性方法判断H2SO3为弱电解质,可设计实验为:用pH试纸检验Na2SO3溶液,试纸变蓝或用pH试纸(或pH计)检测0.01mol·L-1 NaHSO3,pH>2,故答案为:用pH试纸检验Na2SO3溶液,试纸变蓝或用pH试纸(或pH计)检测0.01mol·L-1 NaHSO3,pH>2。

【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
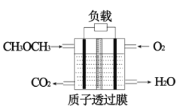
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。
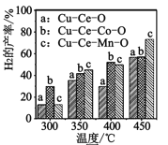
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
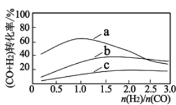
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
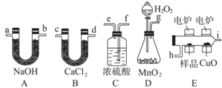
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D