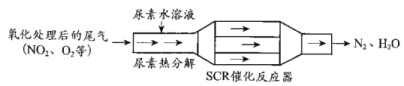
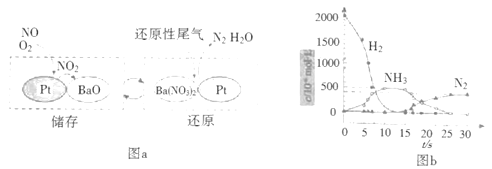
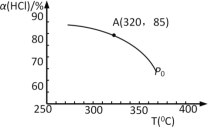
题目内容
【题目】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________,其最外层有____种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________。
②上述反应中,若转移了3mol电子,得到的还原产物是__________mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________晶体,Ni(CO)4易溶于下列_______(填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
【答案】![]() 4 C和Si最外层电子数相同,C原子半径小于Si,所以硅元素的非金属性弱于碳元素,硅烷的热稳定性弱于甲烷 4CrO42-+6S+7H2O →4Cr(OH)3↓+3S2O32-+2OH- 1 CrO2-+ H++ H2O
4 C和Si最外层电子数相同,C原子半径小于Si,所以硅元素的非金属性弱于碳元素,硅烷的热稳定性弱于甲烷 4CrO42-+6S+7H2O →4Cr(OH)3↓+3S2O32-+2OH- 1 CrO2-+ H++ H2O![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH- 分子晶体 b、c
Cr3++3OH- 分子晶体 b、c
【解析】
(1) 碳原子最外层有4个电子,2s能级上有2个电子、2p能级上有2个电子,根据构造原理、泡利原理、洪特规则,其最外层电子的轨道表示式为![]() ;每个电子的运动状态都是不一样的,所以有4种不同运动状态的电子。
;每个电子的运动状态都是不一样的,所以有4种不同运动状态的电子。
(2) C和Si最外层电子数相同(是同主族元素),C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,故硅烷的分解温度远低于甲烷。
(3) ①该反应中S元素化合价由0价变为+2价、Cr元素化合价由+6价变为+3价,根据化合价总变化相等,可知CrO42-与S的比值为2:3,再根据原子守恒可以配平Cr(OH)3与S2O32-,生成物中缺的物质是OH-,可利用电荷守恒配平,最后配水即可,4CrO42-+6S+7H2O →4Cr(OH)3↓+3S2O32-+2OH-。
②该反应中还原产物是Cr(OH)3,根据还原产物和转移电子之间的关系式可知若转移了3mol电子,得到的还原产物的物质的量3mol/3=1 mol。
③根据氢氧化铝的电离方程式,可知Cr(OH)3的电离方程式为CrO2-+ H++ H2O![]() Cr(OH)3
Cr(OH)3 ![]() Cr3++3OH-。
Cr3++3OH-。
(4) 根据该物质的熔沸点可知,该物质属于分子晶体,该物质的结构为正四面体结构,正负电荷中心重合,为非极性分子,根据相似相溶原理知,非极性分子的溶质易溶于非极性分子的溶剂,苯和四氯化碳都是非极性分子,所以该物质易溶于苯和四氯化碳。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置,写出A中发生反应的离子方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _____________ |
C | ___________ | _______________ |
D | NaOH溶液 | _____________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式______________________。
(4)用_______________检验F中收集到的气体,现象是_________________。
【题目】化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项 | 现象或事实 | 解释 |
A | Na2O2常用于潜水艇或呼吸面具的供氧剂 | Na2O2与H2O、CO2反应产生O2 |
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C | FeCl3溶液可用于刻制印刷铜电路板 | FeCl3可与Cu发生反应 |
D | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | 烧菜时铁锅被染色 |
A.AB.BC.CD.D