题目内容
20.要想除去丙烷中的乙烯并得到纯净的丙烷,可选择的试剂是( )| A. | NaOH 溶液、浓H2SO4 | B. | 溴的四氯化碳溶液、浓H2SO4 | ||
| C. | 乙醇、浓H2SO4 | D. | 酸性高锰酸钾溶液、浓H2SO4 |
分析 乙烯含有碳碳双键,可与溴水发生加成反应,可与酸性高锰酸钾发生氧化还原反应生成二氧化碳气体,以此解答该题.
解答 解:A.二者都不与氢氧化钠反应,不能除去杂质,故A错误;
B.乙烯与水发生加成反应,可除杂,故B正确;
C.二者与乙醇不反应,且乙醇易挥发,不能用于除杂,故C错误;
D.乙烯被酸性高锰酸钾氧化生成二氧化碳气体,引入新杂质,故D错误.
故选B.
点评 本题考查物质的分离、提纯,为高考常见题型,侧重于考查学生的分析能力和实验能力,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.

练习册系列答案
相关题目
10.下列微粒属于等电子体的是( )
| A. | 12CO2和14CO | B. | H2O和NH3 | C. | N2和13CO | D. | NO和CO |
8.下列第IA族元素中,金属元素最弱的是( )
| A. | 锂 | B. | 钠 | C. | 钾 | D. | 铷 |
15.甲烷和氯气以物质的量1:1混合,在光照条件下,得到的产物是( )
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
5.1纳米(nm)=10-9m,“纳米材料”是指直径以几纳米到几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是( )
| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
12.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | D>B>A>C |
2.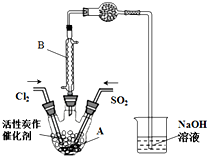 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)△_MnCl2+Cl2↑+2H2O.
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率(用含X、Y的代数式表示).
3.下列说法正确的是( )
| A. | 实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 | |
| B. | 检验硫酸亚铁铵晶体中是否含有结晶水:取一试管,用药匙加入2克硫酸亚铁铵晶体,并在试管口塞上一团蘸有少量无水硫酸铜粉末的棉花,同时塞紧塞子,点燃酒精灯加热试管,观察现象 | |
| C. | 取一药匙铁粉、半药匙食盐置于一片塑料薄膜上,混合均匀,滴一滴管水,包起塑料薄膜(不包紧,有空气),用手摸立刻有发烫感 | |
| D. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 |
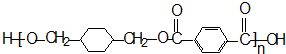
 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl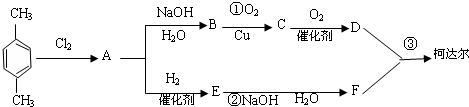
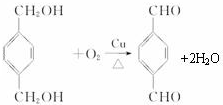
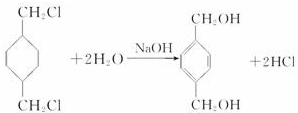
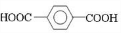 +
+
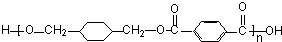 +(2n-1)H2O.
+(2n-1)H2O.