题目内容
(12分)A、B、C、D、E是位于短周期的主族元素。已知:
①热稳定性:HmD>HmC;
②Cm-、E(m-1)-具有相同的电子层结构;
③A、B与C在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小;
④A与B质子数之和是D质子数的3倍。
依据上述信息用相应的化学用语回答下列问题:
考查原子核外电子的排布规律及元素周期律等。
(1)HmDm的电子式为
(2)Cm-、E(m-1)-的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)B单质与A的最高价氧化物对应水化物反应的化学方程式为:______________________。
(4)常温下,将CDm通入HmC溶液中,有C析出,写出该过程的化学方程式 。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
①热稳定性:HmD>HmC;
②Cm-、E(m-1)-具有相同的电子层结构;
③A、B与C在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小;
④A与B质子数之和是D质子数的3倍。
依据上述信息用相应的化学用语回答下列问题:
考查原子核外电子的排布规律及元素周期律等。
(1)HmDm的电子式为
(2)Cm-、E(m-1)-的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)B单质与A的最高价氧化物对应水化物反应的化学方程式为:______________________。
(4)常温下,将CDm通入HmC溶液中,有C析出,写出该过程的化学方程式 。
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

(1) 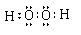 (2) S2->Cl-;Cl2 + S2-= 2Cl-+ S↓
(2) S2->Cl-;Cl2 + S2-= 2Cl-+ S↓
(3) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
(4) 2H2S + SO2 =" 3S↓+" 2H2O (5) Na、S
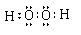 (2) S2->Cl-;Cl2 + S2-= 2Cl-+ S↓
(2) S2->Cl-;Cl2 + S2-= 2Cl-+ S↓ (3) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
(4) 2H2S + SO2 =" 3S↓+" 2H2O (5) Na、S
根据①可判断,D的非金属性强于C的。由②可知C的非金属性强于E的。由③可知A、B是金属,原子序数为A<B<C。A的原子半径最大,B的离子半径最小,所以A是Na,B是Al,因此D是O,C是S,E是P。
(1)HmDm是过氧化氢,含有极性键和非极性键,电子式为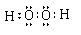
(2)非金属性越强,相应阴离子的还原性越弱,所以还原性是S2->Cl-。比较元素非金属性强弱可以利用单质之间的相互置换能力进行比较。
(3)铝和氢氧化钠反应生成氢气和偏铝酸钠、水。
(4)SO2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成单质硫和水。
(5)Na→Na2O→Na2O2→NaOH,S→SO2→SO3→H2SO4,所以正确的是钠和硫。
(1)HmDm是过氧化氢,含有极性键和非极性键,电子式为
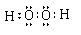
(2)非金属性越强,相应阴离子的还原性越弱,所以还原性是S2->Cl-。比较元素非金属性强弱可以利用单质之间的相互置换能力进行比较。
(3)铝和氢氧化钠反应生成氢气和偏铝酸钠、水。
(4)SO2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成单质硫和水。
(5)Na→Na2O→Na2O2→NaOH,S→SO2→SO3→H2SO4,所以正确的是钠和硫。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目