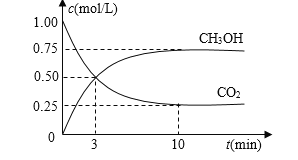
题目内容
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:

(1) Na2S溶液显碱性,写出相关反应的方程式(主要)______,上述流程中采用稀碱液比用热水更好,理由是___________。
(2)常温下,等体积、等物质的量浓度的NaHS溶液与Na2S溶液混合,混合溶液中c(S2-)_____c(HS-) (填“大于”、“小于”或“等于”)。若混合溶液的pH=10,则c(HS-)+3c(H2S)-c(S2-)= ___________________
(3)已知:I2+2S2O32-=2I-+S4O62-。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数_________(写出计算过程)。
【答案】![]() 热水会促进Na2S水解,而稀碱液能抑制Na2S水解 小于 1×10-4mol/L或2×(10-4-10-10)mol/L
热水会促进Na2S水解,而稀碱液能抑制Na2S水解 小于 1×10-4mol/L或2×(10-4-10-10)mol/L ![]() 溶液由蓝色变为无色,且半分钟内不变色 步骤b中消耗的I2有:
溶液由蓝色变为无色,且半分钟内不变色 步骤b中消耗的I2有:
n(I2)=0.05000 mol·L-1×5.00 mL×10-3 L·mL-1=2.500×10-4mol
n(Na2S2O3·5H2O)=2n(I2)=5.000×10-4 mol
w(Na2S2O3·5H2O)=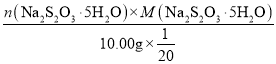 ×100%=
×100%=![]() ×100%=24.8%,
×100%=24.8%,
步骤c中,加入的I2:
n(I2)=0.05000 mol·L-1×50.00 mL×10-3 L·mL-1=2.500×10-3 mol
由步骤b可知25mL溶液中Na2S2O3消耗的I2:2.500×10-4 mol
滴入的标准Na2S2O3溶液消耗多余的I2:15mL×10-3 L·mL-1×0.1000mol·L-1×![]() =7.5×10-4 mol
=7.5×10-4 mol
溶液中有Na2S有:
n(Na2S)=(2.500×10-3-2.500×10-4-7.5×10-4)mol=1.500×10-3mol
w(Na2S·9H2O)=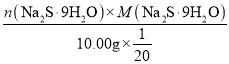 ×100%=
×100%=![]() =72.0%
=72.0%
【解析】
(1)H2S为二元弱酸,S2-的水解主要是一级水解,其反应方程式为:![]() ;因水解反应为吸热反应,升高温度有利于水解的进行,热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
;因水解反应为吸热反应,升高温度有利于水解的进行,热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(2)S2-的水解程度大于HS-,而S2-水解生成HS-,而S2-水解程度大于HS-电离,故c(S2-)<c(HS-);等浓度等体积的NaHS溶液与Na2S溶液混合,钠元素的物质的量为硫元素的物质的量的1.5倍,故![]() ,根据电荷守恒:
,根据电荷守恒:![]() ,两式联立可得:
,两式联立可得:![]() ,常温下,pH=10,c(H+)=1×10-10mol/L,c(OH-)=1×10-4mol/L,故
,常温下,pH=10,c(H+)=1×10-10mol/L,c(OH-)=1×10-4mol/L,故![]() ;
;
(3)①ZnCO3除去Na2S的离子方程式为:![]() ;
;
②滴定终点时I2完全反应,所以滴定终点为:溶液由蓝色变为无色,且半分钟内不变色;
③样品中N2S·9H2O和Na2S2O3·5H2O均可以与I2反应,步骤b中测量的Na2S2O3·5H2O的量,步骤c测量的是样品中Na2S·9H2O和Na2S2O3·5H2O的总量,求Na2S·9H2O的量,用总量减去Na2S2O3·5H2O的量即可;
步骤b中消耗的I2有:
n(I2)=0.05000 mol·L-1×5.00 mL×10-3 L·mL-1=2.500×10-4mol
n(Na2S2O3·5H2O)=2n(I2)=5.000×10-4 mol
w(Na2S2O3·5H2O)=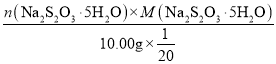 ×100%=
×100%=![]() ×100%=24.8%,
×100%=24.8%,
步骤c中,加入的I2:
n(I2)=0.05000 mol·L-1×50.00 mL×10-3 L·mL-1=2.500×10-3 mol
由步骤b可知25mL溶液中Na2S2O3消耗的I2:2.500×10-4 mol
滴入的标准Na2S2O3溶液消耗多余的I2:15mL×10-3 L·mL-1×0.1000mol·L-1×![]() =7.5×10-4 mol
=7.5×10-4 mol
溶液中有Na2S有:n(Na2S)=(2.500×10-3-2.500×10-4-7.5×10-4)mol=1.500×10-3mol,
w(Na2S·9H2O)=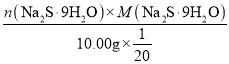 ×100%=
×100%=![]() =72.0%。
=72.0%。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】从某含Br-废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。
已知:①2NaOH+Cl2==NaCl+NaClO+H2O
②Br2极易溶于四氯化碳和正十二烷
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
在水中溶解性 | 微溶 | 难溶 | 难溶 |

下列说法不正确的是
A. 甲装置中Br-发生的反应为:2Br-+Cl2===Br2+2Cl-
B. 甲装置中NaOH溶液每吸收1个Cl2,转移1个e-
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2