题目内容
【题目】I. 锶(Sr)原子序数为 38,在周期表中的位置为_____关于锶及其化合物的说法中不正确的是_________
a. 锶能与冷水剧烈反应
b. 锶的失电子能力比钙强
c. Sr(OH)2 的碱性比 Ca(OH)2 弱
d. 氧化锶是碱性氧化物
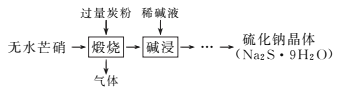
II.高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量 Ba、Fe 的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
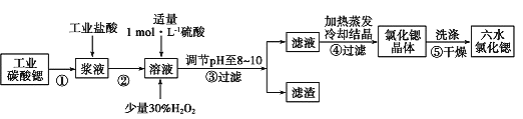
请回答:
(1)已知常温下,NaCl 溶液、BaCl2 溶液呈中性,而 MgCl2 、CuCl2 溶液呈酸性。常温下,SrCl2 溶液 pH_____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是_________(填化学式),调节溶液 pH 至 8~10,宜选用的试剂为_____。
a.稀硫酸 b.氢氧化锶粉末 c.氢氧化钠 d.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用_____。
a.水 b.稀硫酸 c.氢氧化钠溶液 d.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是_____(填字母)。
a.50~60℃ b.70~80℃ c.80~100℃ d.100℃以上
【答案】第五周期ⅡA 族 c 等于 BaSO4、Fe(OH)3 b d d a
【解析】
I.锶(Sr)原子序数为 38,原子结构示意图为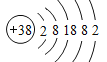 ;锶、钙同主族,根据元素性质递变规律判断;
;锶、钙同主族,根据元素性质递变规律判断;
II.以SrCO3为原料制备六水氯化锶(SrCl2·6H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2·6H2O。
(1)锶(Sr)原子序数为 38,原子结构示意图为 ,有5个电子层,最外层2个电子,在周期表中的位置为第五周期ⅡA 族;
,有5个电子层,最外层2个电子,在周期表中的位置为第五周期ⅡA 族;
a. 锶的活金属性大于钙,所以锶能与冷水剧烈反应,故a正确;
b.锶、钙同主族,锶的半径大于钙,所以锶的失电子能力比钙强,故b正确;
c.锶、钙同主族,锶的半径大于钙,Sr(OH)2 的碱性比 Ca(OH)2 强,故c错误;
d. 氧化锶和盐酸反应生成氯化锶和水,氧化锶是碱性氧化物,故d正确;选c。
II.(1)SrCl2是强酸强碱盐,SrCl2溶液呈中性,pH等于7;
(2)SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为BaSO4、Fe(OH)3;调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末,故选bd;
(3)SrCl2·6H2O易溶于水,为减少晶体溶解,提高产量,洗涤氯化锶晶体最好选用氯化锶饱和溶液,选d;
(4)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃,故选a。