题目内容
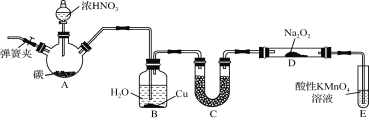
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO![]() ,MnO
,MnO![]() 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1) 装置A三颈烧瓶中发生反应的化学方程式为 。
(2) B装置的目的是① ,② 。
(3) 为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4) E装置发生反应的离子方程式是 。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸
B.c1mol·L-1KI溶液
C.淀粉溶液
D.c2mol·L-1Na2S2O3溶液
E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
【答案】
(1)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)①将NO2转化为NO;②铜与稀硝酸反应生成NO
(3)BD;
(4)3MnO4-+4H++5NO=3Mn2++5NO3-+2H2O;
(5)①E;
②加入过量的c1mol·L-1KI溶液、淀粉溶液,然后滴加稀硫酸,充分反应后,用c2mol·L-1Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操作2~3次。
【解析】
试题分析:(1)装置A三颈烧瓶中发生反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)B装置的目的是①将NO2转化为NO、②铜与稀硝酸反应生成NO,故答案为:①将NO2转化为NO;②铜与稀硝酸反应生成NO;
(3)A、C不能吸收酸,B、D可吸收酸且干燥气体,故答案为:BD;
(4)由信息可知,E装置的作用是吸收有毒的NO气体,避免污染空气,反应的离子方程式为3MnO4- +4 H+ +5NO = 3Mn2+ + 5NO3- +2 H2O,故答案为:3MnO4- +4 H+ +5NO = 3Mn2+ + 5NO3- +2 H2O;
(5)①由信息NO能被酸性KMnO4氧化成NO3-可知,则利用NaNO2的还原性来测定其纯度,可选择的试剂是E,故答案为:E;②由信息酸性条件下NaNO2能把I-氧化为I2可知,则利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m的NaNO2样品放入锥形瓶中,加适量水溶解,加入过量的c1 molL-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 molL-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操作2~3次,故答案为:加入过量的c1 molL-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 molL-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操作2~3次。

 灵星计算小达人系列答案
灵星计算小达人系列答案