题目内容
【题目】据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ·mol-1。请回答下列问题:
(1)N60分子组成的晶体为______晶体,其熔、沸点比N2______(填“高”或“低”),原因是________________________。
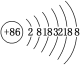
(2)1 mol N60分解成N2时吸收或放出的热量是________ kJ(已知![]() 键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
键的键能为942 kJ·mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种)________________________。
【答案】 分子 高 N60和N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高 13230 < N60可作高能炸药
【解析】(1)N60、N2均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大的,分子间作用力大,其熔、沸点就越高;正确答案:分子;高; N60和N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高。
(2)每个氮原子均以N—N键结合三个N原子,每个N—N键被2个氮原子共用,每个氮原子有1.5个N—N键,1个N60分子结构中含有1.5×60=90个N—N键;根据反应:N60(s)==30N2(g)H;H=反应物断键吸收的总能量-生成物成键放出的总能量=167×90-30×942=-13230 kJ·mol-1;该反应放热,N60能量高不稳定,所以稳定性N60<N2;正确答案:13230; <。
(3) N60不稳定,变为氮气时,放出非常多的能量,可作高能炸药;正确答案:N60可作高能炸药。

 小学课时特训系列答案
小学课时特训系列答案【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。