题目内容
【题目】据报道,某些花岗岩会产生氡(![]() Rn),对人体产生伤害。请回答:
Rn),对人体产生伤害。请回答:
(1)该原子的质量数是________,质子数是________,中子数是________。
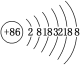
(2)请根据Rn的原子结构预测,氡气的化学性质________。
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼
D.很难与其他物质发生反应
你选择该选项的理由是______________________________________________。
(3)研究发现,镭能蜕变为![]() Rn,故称
Rn,故称![]() Rn为镭射气;钍能蜕变为
Rn为镭射气;钍能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为钍射气;锕能蜕变为
Rn称为钍射气;锕能蜕变为![]() Rn,故将
Rn,故将![]() Rn称为锕射气。则
Rn称为锕射气。则![]() Rn、
Rn、![]() Rn、
Rn、![]() Rn是________。
Rn是________。
A.同种元素 B.同位素
C.同种核素 D.同种原子
【答案】222 86 136 D Rn原子最外层已达8电子稳定结构,因此氡气很稳定 A、B
【解析】
(1)元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,据此进行分析;
(2)Rn的原子最外层已达8电子稳定结构,性质稳定;
(3)根据元素、核素、同位素的概念进行分析。
(1) 元素符号左下角数字表示质子数、左上角数字表示质量数,中子数=质量数-质子数,所以该原子质量数是222,质子数是86,中子数=222-86=136;
综上所述,本题答案是:222,86,136。
(2) 该原子结构示意图为 ,最外层有8个电子,性质较稳定,不易和其它物质发生反应,所以D选项是正确的;
,最外层有8个电子,性质较稳定,不易和其它物质发生反应,所以D选项是正确的;
因此,本题正确答案是:D,Rn原子最外层已达8电子稳定结构,因此氡气很稳定。
(3) 这三种微粒的质子数相同、中子数不同,所以是同一元素的不同核素,属于同位素,所以AB选项是正确的;
综上所述,本题选. A、B。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D