��Ŀ����
����Ŀ����ҵ�ϳ�ͨ�����·ֽ�FeSO4�ķ����Ʊ�Fe2O3,�仯ѧ����ʽΪ��2FeSO4![]() Fe2O3+SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ���,��������ʵ��
Fe2O3+SO2��+SO3��Ϊ����FeSO4���·ֽ�IJ���,��������ʵ��
(1)�������Fe2O3ȡ����FeSO4���·ֽ�õ��Ĺ���,����һ����__________�ܽ�,�������Һ�м���������__________��Һ,����____________�������,��֤�������д���Fe2O3
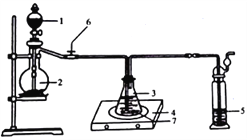
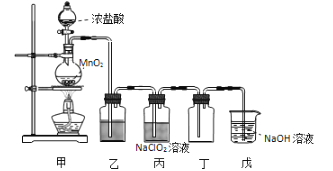
(2)�����������:��FeSO4���·ֽ����������ͨ����ͼ����װ����,�Լ���������������Ƿ���SO2��SO3��
������װ����������Ϊ_______________(��װ�����)
��ʵ������۲쵽װ��A��Ʒ����Һ______,װ��B BaCl2��Һ��__________,���֤��FeSO4���·ֽ�����������к���SO2��SO3��
��װ��C��NaOH��Һ��������_______________(�����ӷ���ʽ��ʾ����

���𰸡�ϡ����(��ϡ����) KSCN��Һ ��Һ��� BAC ��ɫ ��ɫ���� SO2+2OH-==SO32-+H2O
��������
��1��Fe3+�ļ��飺����������KSCN��Һ����Һ���Ѫ��ɫ��
��2��SO2��ʹƷ����Һ��ɫ��SO3ͨ�뵽BaCl2��Һ�У��������ᱵ��ɫ������
��1����FeSO4���·ֽ�õ��Ĺ����м���һ����ϡ����(��ϡ����)�ܽ⣬�����Һ�м���������KSCN��Һ����Һ���Ѫ��ɫ��˵����Fe3+���ɣ���˵�������д���Fe2O3��
�ʴ�Ϊ��ϡ����(��ϡ����)��KSCN��Һ����Һ��졣
��2�����Ȱѻ������ͨ�뵽�Ȼ�����Һ�У�������ɫ��������ͨ�뵽Ʒ����Һ�У�Ʒ����ɫ�����ͨ�뵽����������Һ�н���β���������ʴ�Ϊ��BAC ��
��SO2��ʹƷ����Һ��ɫ��SO3ͨ�뵽BaCl2��Һ�У��������ᱵ��ɫ�������ʴ�Ϊ����ɫ����ɫ������
��װ��C��NaOH��Һ�������dz�ȥ�����SO2����ֹ��Ⱦ�������ʴ�Ϊ��SO2+2OH-==SO32-+H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����и��������ܴ������棬�ҵ������Լ���Ӧ�����ӷ���ʽ��д��ȷ����( )
ѡ�� | ������ | �����Լ� | ������Ӧ�����ӷ���ʽ |
A | Fe3+��I-��Cl- | NaOH��Һ | Fe3+ + 3OH- =Fe(OH)3�� |
B | K+��ClO-��SO42- | ���� | H++ClO- =HClO |
C | K+��OH-��Cl- | ����SO2 | SO2+ OH-=HSO3- |
D | H+��Fe2+�� SO42- | Ba(NO3)2��Һ | SO42-+ Ba2+ =BaSO4�� |
A. A B. B C. C D. D
����Ŀ��̼����Ȼ�����γɻ�������������Ԫ�أ�CO��CO2��̼����������
��1���о��ͽ��������̼������ת�������ǵ�ǰ��ѧ�о���ǰ��������̫���ܵ������£�ȱ��������[Fe0.9O]�ֽܷ�CO2���������ͼ1��ʾ���������Ļ�ѧ����ʽ��______���ڹ�������ÿ����0.1molO2��ת�Ƶ���______mol��

��2���ڴ��������£���������̼��������Ϸ�Ӧ���ɼ��飬��Ŀǰ��ѧ��������̽���Ĵ��������еĶ�����̼�ķ���֮һ��
����֪��
���ۼ� | C=O | H��H | C��H | O��H |
����/(kJmol��1) | 745 | 436 | 413 | 463 |
��CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ��H=______kJmol��1��
CH4(g)+2H2O(g) ��H=______kJmol��1��
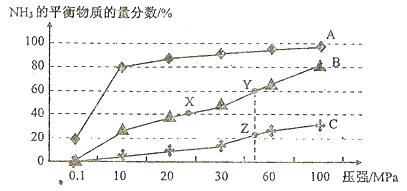
����1L�̶��ݻ����ܱ������м���4.0 mol H2(g)��1.0mol CO2����������������������þ�Ͻ𡢸���T1��ʹ֮��Ӧ������������������ѹǿ����ʱ��ı仯��ͼ2��ʾ����4 minʱ������������ܶ�Ϊ______���¶�T1 �£��÷�Ӧ�Ļ�ѧƽ�ⳣΪ______��������2 L�̶��ݻ����ܱ�������Ͷ�����������ͷ�Ӧ�¶Ⱦ����ֲ��䣬��Ӧ���´ﵽƽ��ʱ��Ӧ��ϵ�ڵ�ѹǿ�ĵ���______������ĸ����
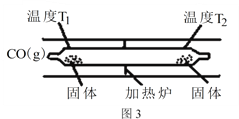
��3����ҵ�ϳ�ԭ����CO�����豸���ܵ�����������Ľ�����������Ӧ�������ʻ���������ʻ������ȷֽⷨ�Ʊ��ߴ�����ԭ�ϣ�Ҳ���л��ϳ��й���һ����̼��ԭ�ϣ�������������Ni(s)+4CO(g)![]() Ni(CO)4(g) ��H��0 Ni(CO)4(g)
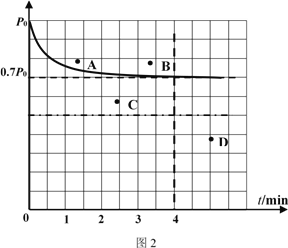
Ni(CO)4(g) ��H��0 Ni(CO)4(g)![]() Ni(s)+4CO(g)����ͼ3��ʾ����ʯӢ��չܵ��¶�ΪT1һ�ˣ���������������CO(g)��һ��ʱ������¶�ΪT2��һ�˿ɵõ��������������¶�T1______T2����������������������������������Ӧ��ϵ��ѭ��ʹ�õ�����Ϊ______���ѧʽ����
Ni(s)+4CO(g)����ͼ3��ʾ����ʯӢ��չܵ��¶�ΪT1һ�ˣ���������������CO(g)��һ��ʱ������¶�ΪT2��һ�˿ɵõ��������������¶�T1______T2����������������������������������Ӧ��ϵ��ѭ��ʹ�õ�����Ϊ______���ѧʽ����