题目内容
8.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )| A. | 标准状况下,22.4L辛烷的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28gC2H4所含共用电子对数目为6NA |
分析 A、标况下,辛烷为液态;
B、甲基显电中性;
C、1,3-丁二烯为二烯烃;
D、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来计算.
解答 解:A、标况下,辛烷为液态,不能根据气体摩尔体积来计算,故A错误;
B、甲基显电中性,故1mol甲基含9mol电子,即9NA个,故B正确;
C、1,3-丁二烯为二烯烃,1mol1,3-丁二烯含2mol碳碳双键,故0.5mol1,3-丁二烯含1mol碳碳双键,即NA个,故C正确;
D、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,即6NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.下列表述正确的是( )
| A. | CH3F的电子式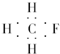 | B. | Na2S的电子式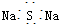 | C. | 氢氧根的电子式 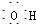 | D. | 次氯酸的电子式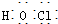 |
19.用乙炔为原料制取CH2BrCHBrCl,可行的反应途径是在一定条件下( )
| A. | 先与Cl2加成,再与Br2加成 | B. | 先与Cl2加成,再与HBr加成 | ||
| C. | 先与HCl加成,再与Br2加成 | D. | 先与HCl加成,再与HBr加成 |
16.下列关于浓硫酸和浓硝酸的说法正确的是( )
| A. | 浓硫酸和浓硝酸都能用来直接跟锌粒反应制氢气 | |
| B. | 浓硫酸和浓硝酸都能与单质碳反应 | |
| C. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| D. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 |
13.下列有关实验的说法中,正确的是( )
| A. | 可用溴的四氯化碳溶液区分直馏汽油和裂化汽油 | |
| B. | 用NaOH、AgNO3两种溶液即可验证溴乙烷中溴元素的存在 | |
| C. | 将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 蛋白质溶液中分别加入浓HNO3、10%NaOH溶液、0.1%茚三酮溶液均产生白色沉淀 |
20.化学与人类生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 大量使用化肥和农药,以提高农作物产量 | |
| B. | 太阳能热水器、沼气的使用、玉米制乙醇都涉及生物质能的利用 | |
| C. | 开发废旧电池综合利用技术,防止重金属盐对土壤、水资源造成污染 | |
| D. | H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用 |
18. 纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )
纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )
 纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )
纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )| A. | Mg3B6 | B. | Mg14B6 | C. | MgB2 | D. | Mg5B12 |
 ,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.