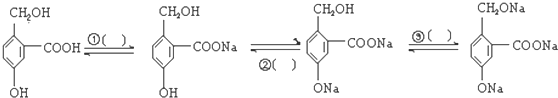
题目内容
3.现有Cl2、NH3、H2S、SO2四种气体,常温常压下在水中溶解度最大的是NH3,N2的电子式 ,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
,它的常见氢化物的空间结构为三角锥形,工业固氮制备该氢化物的原理(反应方程式)是N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
分析 氨气极易溶于水,氮气是由两个氮原子形成3对共价键形成的,氨气为三角锥形,工业上合成氨是氮气和氢气在催化剂高温高压的条件合成氨气,据此解答即可.
解答 解:Cl2、NH3、H2S、SO2四种气体中,常温常压下在水中溶解度最大的是氨气,N2的电子式为: ,它的常见氢化物即为氨气,氨气的空间结构为三角锥形,在高温高压催化剂的条件下,氮气和氢气反应生成氨气,化学方程式为:N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3,
,它的常见氢化物即为氨气,氨气的空间结构为三角锥形,在高温高压催化剂的条件下,氮气和氢气反应生成氨气,化学方程式为:N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3,
故答案为:NH3; ;三角锥形;N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
;三角锥形;N2+3H2$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3.
点评 本题主要考查的是氨气的物理性质、电子式书写、空间构型判断以及工业制取氨气化学反应方程式书写,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
11.下列实验中,溶液颜色不会发生变化的是( )
| A. | SO2通入品红溶液 | B. | 碘酒滴入淀粉溶液 | ||
| C. | 乙烯通入酸性KMnO4溶液中 | D. | Cl2通入NaOH溶液中 |
18.下列哪种说法可以证明恒温恒容下,可逆反应.N2(g)+3H2(g)?2NH3(g)已达到平衡状态( )
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的平均分子量不再改变 | |
| C. | 混合气体中,N2、H2、NH3的物质的量之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个N-H键形成 |
8.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,22.4L辛烷的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28gC2H4所含共用电子对数目为6NA |
12.关于下列有机反应的说法中,不正确的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl是取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br是加成反应 | |
| C. | 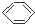 +HO-NO2$→_{60℃}^{浓硫酸}$ +HO-NO2$→_{60℃}^{浓硫酸}$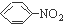 +H2O是取代反应 +H2O是取代反应 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O是加成反应 |
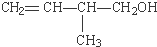 的键线式
的键线式