题目内容
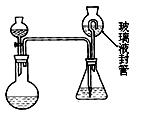
为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
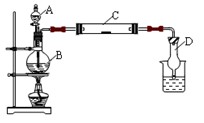
(1)怎样检验装置的气密性 ;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为 ;写出
B中发生反应的离子方程式 。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是 。
(4)D的作用是_______________。烧杯中加入的是 。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用 药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用 药品替代。

(1)怎样检验装置的气密性 ;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为 ;写出
B中发生反应的离子方程式 。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是 。
(4)D的作用是_______________。烧杯中加入的是 。

(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用 药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用 药品替代。
(12分)(1)关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱。(2分)
(2)试纸变蓝色(1分)。MnO2 +2Cl- +4H+ Mn2+ +Cl2↑ +2H2O(2分)
Mn2+ +Cl2↑ +2H2O(2分)
(3)将KI氧化成KIO3 (2分)
(4)防倒吸(1分)氢氧化钠溶液(1分)
(5)KMnO4、KClO3(合理 给分)(2分);NaCl和浓硫酸(1分)
给分)(2分);NaCl和浓硫酸(1分)
(2)试纸变蓝色(1分)。MnO2 +2Cl- +4H+
 Mn2+ +Cl2↑ +2H2O(2分)
Mn2+ +Cl2↑ +2H2O(2分)(3)将KI氧化成KIO3 (2分)
(4)防倒吸(1分)氢氧化钠溶液(1分)
(5)KMnO4、KClO3(合理
 给分)(2分);NaCl和浓硫酸(1分)
给分)(2分);NaCl和浓硫酸(1分)略

练习册系列答案
相关题目
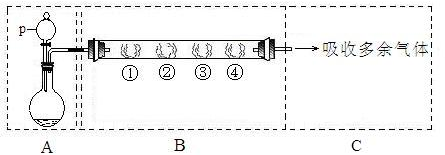

 __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。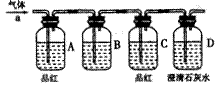
 某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题: 方程式为:
方程式为: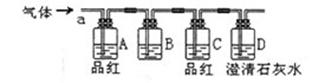
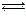 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
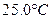 时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。
时,0-6min 氨基甲酸铵水解反应的平抑速率 ______。