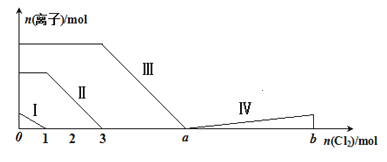
题目内容
【题目】对下列有机化学的认识中,错误的是
A. 反应 ![]() 属于取代反应
属于取代反应
B. 淀粉和纤维素属于多糖,在人体内水解转化为葡萄糖,为人类提供能量
C. 分枝酸结构简式如图 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D. 取蔗糖水解液少许,先滴加过量的NaOH溶液,再滴入新制的氢氧化铜悬浊液,加热,有红色沉淀生成,证明其水解产物具有还原性
【答案】B
【解析】![]() +Br2
+Br2![]() +HBr,溴原子代替苯环上的氢原子,所以属于取代反应,故A正确;纤维素在人体内不能水解,故B错误;分枝酸含有羧基、羟基,可与乙醇、乙酸发生酯化反应;分枝酸含有碳碳双键可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,故C正确;取蔗糖水解液少许,先滴加过量的NaOH溶液中和硫酸,再滴入新制的氢氧化铜悬独液,加热,有红色氧化亚铜沉淀生成,说明水解产物中含有葡萄糖,故D正确。
+HBr,溴原子代替苯环上的氢原子,所以属于取代反应,故A正确;纤维素在人体内不能水解,故B错误;分枝酸含有羧基、羟基,可与乙醇、乙酸发生酯化反应;分枝酸含有碳碳双键可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,故C正确;取蔗糖水解液少许,先滴加过量的NaOH溶液中和硫酸,再滴入新制的氢氧化铜悬独液,加热,有红色氧化亚铜沉淀生成,说明水解产物中含有葡萄糖,故D正确。

 名校课堂系列答案
名校课堂系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:
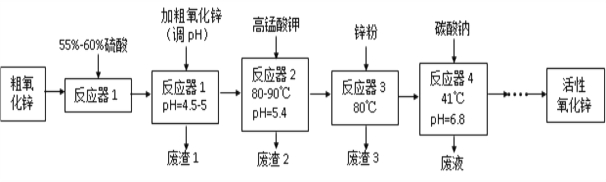
已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。