题目内容
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
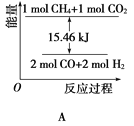
(2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是________(填字母)。



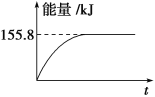
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
【答案】= D 63% -74.8kJ·mol-1 C
【解析】
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890,.3kJmol-1,得到甲烷细菌使1mol甲烷生成CO2气体与液态水放出的热量;(2)①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量,反应为放热反应,据此分析图象判断;②依据①计算得到的反应的焓变,图中中是反应达到平衡状态时放热155.8KJ,计算反应的甲烷得到转化率;
(3)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol;②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1;③C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+③-①得到,由此分析解答;(4)CO2与H2O反应生成CH4与O2的反应吸热,故A项不正确;使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生,故B项不正确;利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)是合理的,C项正确;将固态碳合成为C60,以C60作为燃料,极不经济合算,故D项不正确。
(1)给定反应的反应热只取决于反应物和生成物的多少和状态,与中间过程无关,故甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量仍等于890.3 kJ。(2)①1 g CH4完全反应释放15.46 kJ的热量,则1 mol CH4完全反应放出热量为247.36 kJ,故D图符合题意;②CH4的转化率=155.8/247.36 ×100%≈63%。(3)②+③-①即得C(s)+2H2(g)=CH4(g) ΔH=-74.8 kJ·mol-1。(4)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则CO2与H2O反应生成CH4与O2的反应吸热,故A项不正确;使CO2分解生成碳与O2的反应为吸热反应,常温下不能发生,故B项不正确;利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)是合理的,C项正确;将固态碳合成为C60,以C60作为燃料,极不经济合算,故D项不正确,故选C。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。