题目内容
7.常温下,下列有说法不正确的是( )| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3•H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:①>②>④>③ |
分析 A.混合液为酸性,则c(H+)>c(OH-),结合混合液中的电荷守恒判断;
B.根据混合液中的电荷守恒和物料守恒分析;
C.稀释过程中,醋酸的电离程度增大,则溶液中醋酸的物质的量减小、氢离子的物质的量增加,据此判断该比值的变化;
D.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解.
解答 解:A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-),故A正确;
B.物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为:c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),二者结合可得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),整理可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故B正确;
C.将pH=a的醋酸稀释为pH=a+1的过程中,醋酸的电离程度增大,溶液中醋酸的物质的量减小、氢离子的物质的量,由于在同一溶液中,c(CH3COOH)/c(H+)=n(CH3COOH)/n(H+),所以该比值减小,故C错误;
D.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故D正确;
故选C.
点评 本题考查离子浓度大小的比较,题目难度中等,熟悉酸的强弱与盐的水解的关系、电荷守恒、水解与电离的程度及相互影响是解答本题的关键,试题侧重考查学生的分析、理解能力.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 单位时间内生成amol O2的同时生成2amol NO的状态 | |
| B. | NO2、NO、O2三者物质的量之比为2:2:1的状态 | |
| C. | 混合气体的密度不随时间变化而变化的状态 | |
| D. | 混合气体的平均相对分子质量不随时间变化而变化的状态 |
①本品为无色液体呈碱性;
②使用时应加水稀释;
③可对餐具进行消毒,并能漂白浅色衣物.
据此判断其有效成分可能是( )
| A. | Cl2 | B. | SO2 | C. | H2O2 | D. | NaClO |
| A. | 氯化银悬浊液滴入过量氨水溶液变澄清:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| B. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 硫酸铁溶液与足量的Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 稀醋酸与石灰石反应制CO2气体:2H++CaCO3═CO2↑+H2O+Ca2+ |
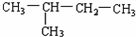 (8)CH2=CH-CH3(9)
(8)CH2=CH-CH3(9)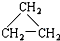 (10)2,2-二甲基丁烷.
(10)2,2-二甲基丁烷.