题目内容
15.某品牌消毒液的商品标识上注明:①本品为无色液体呈碱性;
②使用时应加水稀释;
③可对餐具进行消毒,并能漂白浅色衣物.
据此判断其有效成分可能是( )
| A. | Cl2 | B. | SO2 | C. | H2O2 | D. | NaClO |
分析 ①本品为无色液体,呈碱性,说明为强碱弱酸盐,应含有NaClO;③可对餐具、衣物进行消毒,可漂白浅色衣物,说明物质具有强氧化性.
解答 解:“84”消毒液的有效成份为NaClO,为强碱弱酸盐,溶液呈碱性,可与酸反应生成具有强氧化性和漂白性的HClO,则可对餐具、衣物进行消毒,可漂白浅色衣物.
故选D.
点评 本题考查84消毒液的成份和性质,题目难度不大,注意HClO的性质和用途,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
6.一定温度下可逆反应:A(s)+2B(g)F?2C(g)+D(g);△H<O.现将1molA和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
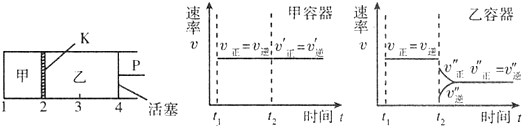

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图所示(t1前的反应速率变化已省略) |
3.人工固氮为粮食丰产奠定了基础.下面能实现人工固氮的是( )
| A. | 闪电 | B. | 由氨制硝酸 | C. | 大豆的根瘤 | D. | 合成氨工厂 |
10.下列有关实验现象或亊实解释正确的是 ( )
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测液中SO42-时,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO32-、SO32-等离子干扰 |
| B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,下列有说法不正确的是( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3•H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:①>②>④>③ |
4.常温下把铁片投入下列溶液中,铁片溶解,且溶液质量增重的是( )
| A. | CuSO4 | B. | ZnSO4 | C. | H2SO4 | D. | KOH |
5.下列关于物质分类的说法正确的是( )
| A. | 稀豆浆、硅酸、氯化铁溶液都属于胶体 | |
| B. | Na2O、MgO、Al2O3均属于碱性氧化物 | |
| C. | 氨水、次氯酸都属于弱电解质 | |
| D. | 葡萄糖、油脂都不属于有机高分子 |
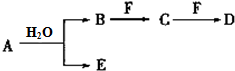 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: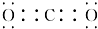 ;D中所含化学键的类型离子键、共价键.
;D中所含化学键的类型离子键、共价键.