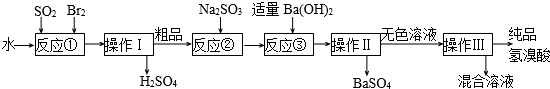
题目内容
17.分子式为C5H12O的有机物A,其结构中含有2个-CH3,在浓硫酸存在下加热生成某烯烃,则符合上述条件的A的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目,此确定醇的同分异构体,然后根据它的同分异构体中,在浓硫酸存在下加热生成某烯烃,说明与羟基所连碳原子相邻的碳原子上含有氢原子,以及含有2个-CH3来筛选;
解答 解:戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CH2CH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则戊醇的可能结构有8种,其中在浓硫酸存在下加热生成某烯烃以及含有2个-CH3的有:HOCH(CH3)CH2CH2CH3、HOCH(CH2CH3)2、HOCH2CH(CH3)CH2CH3、HOCH2CH2CH(CH3)2,故4种,故选B.
点评 本题考查同分异构体的书写,难度较大,注意在浓硫酸存在下加热生成某烯烃,说明与羟基所连碳原子相邻的碳原子上含有氢原子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.常温下,下列有说法不正确的是( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3•H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:①>②>④>③ |
8.下列说法正确的是( )
| A. | 在离子化合物中,可能含共价键 | |
| B. | 在共价化合物中,可能含离子键 | |
| C. | 含共价键的化合物一定是共价化合物 | |
| D. | 含离子键的化合物不一定是离子化合物 |
5.下列关于物质分类的说法正确的是( )
| A. | 稀豆浆、硅酸、氯化铁溶液都属于胶体 | |
| B. | Na2O、MgO、Al2O3均属于碱性氧化物 | |
| C. | 氨水、次氯酸都属于弱电解质 | |
| D. | 葡萄糖、油脂都不属于有机高分子 |
12.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
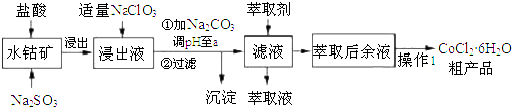
已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发浓缩,冷却结晶和过滤.
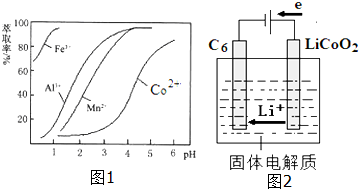
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放点}^{充电}$CoO2+LiC6,则电池放
电时的正极反应式为:CoO2+Li++e-=LiCoO2.

已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发浓缩,冷却结晶和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放点}^{充电}$CoO2+LiC6,则电池放
电时的正极反应式为:CoO2+Li++e-=LiCoO2.

2.下列有关叙述正确的是( )
| A. | 在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液 | |
| B. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL0.50mo1•L-1的硫酸充分反应,两反应测定的中和热不相等 | |
| C. | 如图装置所示,可准确测定中和热 | |
| D. | 进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
9.如图类似于教材P14关于验证“氯气的漂白性实验”的装置图.但在实验时,某同学将A、B两装置的先后位置交换了,则该同学可能看到的实验现象是( )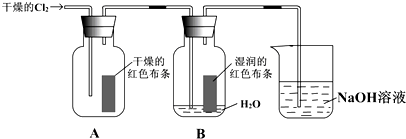

| A. | 只有干燥的布条褪色 | B. | 只有湿润的布条褪色 | ||
| C. | 两块布条均褪色 | D. | 两块布条均不褪色 |
11.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |