题目内容
19.已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的顺序是:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-).分析 先根据溶解度判断沉淀的先后顺序,溶解度小的先生成沉淀,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小.
解答 解:碘化银的溶度积小于氯化银,则在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,
反应后剩余的银离子的物质的量为:n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,
反应后剩余的氯离子的物质的量为:n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,
c(Cl-)=$\frac{2×1{0}^{-5}mol}{0.013L}$=1.53×10-3mol/L,
浊液中c(Ag+)=$\frac{(1.25×{1{0}^{-5})}^{2}}{1.53×1{0}^{-3}}$mol/L=1.02×10-7mol/L,
c(I-)=$\frac{(1.23×1{0}^{-8})^{2}}{1.02×1{0}^{-7}}$=1.46×10-9,
混合溶液中n(K+)=1×10-4mol,
n(NO3-)=0.008L×0.01mol/L=1×10-5mol,则c(K+)>c(NO3-),
故溶液中离子浓度大小为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故答案为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-).
点评 本题考查难溶电解制得溶解平衡及溶液中离子浓度大小比较,题目难度中等,本题注意溶液中各物质的量计算出剩余c(Cl-),再根据Ksp计算银离子浓度和碘离子浓度.

练习册系列答案
相关题目
10.下列有关实验现象或亊实解释正确的是 ( )
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测液中SO42-时,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO32-、SO32-等离子干扰 |
| B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,下列有说法不正确的是( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3•H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:①>②>④>③ |
14.下列对于核素的说法中正确的是( )
| A. | 核素是指质量数相同的微粒 | |
| B. | 核素是指 质子数相同、中子数不同的微粒 | |
| C. | 核素是指具有一定数目的质子和一定数目的中子的一种原子 | |
| D. | 核素是指质子数相同、核外电子数不同的微粒 |
4.常温下把铁片投入下列溶液中,铁片溶解,且溶液质量增重的是( )
| A. | CuSO4 | B. | ZnSO4 | C. | H2SO4 | D. | KOH |
11.下列物质中,不能使干燥的有色布条褪色的是( )
| A. | Cl2 | B. | 氯水 | C. | NaClO溶液 | D. | HClO |
8.下列说法正确的是( )
| A. | 在离子化合物中,可能含共价键 | |
| B. | 在共价化合物中,可能含离子键 | |
| C. | 含共价键的化合物一定是共价化合物 | |
| D. | 含离子键的化合物不一定是离子化合物 |
9.如图类似于教材P14关于验证“氯气的漂白性实验”的装置图.但在实验时,某同学将A、B两装置的先后位置交换了,则该同学可能看到的实验现象是( )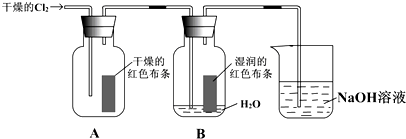

| A. | 只有干燥的布条褪色 | B. | 只有湿润的布条褪色 | ||
| C. | 两块布条均褪色 | D. | 两块布条均不褪色 |