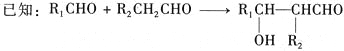题目内容
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol-1。

(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是_____________;
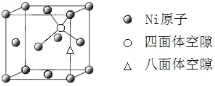
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm (列出计算式)。
【答案】X—射线衍射 ![]() V型 H2O NH2- F>N>O>B sp3 AB 327 由两者的熔点可知,CuCl是分子晶体,而CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力
V型 H2O NH2- F>N>O>B sp3 AB 327 由两者的熔点可知,CuCl是分子晶体,而CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力 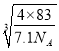 ×107
×107
【解析】
(1)通过X—射线衍射区分晶体、非晶体、准晶体;
(2)根据锑元素原子核外电子排布写出基态锑(Sb)原子价电子排布的轨道式;用价层电子对互斥理论判断[H2F]+的空间构型;用替代法书写与[H2F]+具有相同空间构型和键合形式的分子和阴离子;
(3)①同周期主族元素自左而右原子半径减小,第一电离能呈增大趋势;
②[B(OH)4]﹣中B的价层电子对=4+1/2(3+1-4×1)=4,所以采取sp3杂化;
③NH4BF4(四氟硼酸铵)中含铵根离子和氟硼酸根离子,二者以离子键相结合;铵根离子中含3个σ键和1个配位键,氟硼酸根离子中含3个σ键和1个配位键;
(4)键能指气态基态原子形成1mol化学键释放的最大能量。由图a可知,气态基态S(g)和6F(g)原子形成SF6(g)释放的能量为1962kJ,即形成6molS—F键释放的能量为1962kJ,则形成1molS—F键释放的能量为1962kJ÷6=327kJ,则S—F的键能为327kJ·mol-1;
(5)①CuCl是分子晶体,而CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力,故CuF比CuCl熔点高;
②均摊法计算晶胞中Cu+、F-离子数,计算晶胞质量,晶胞质量=晶体密度×晶胞体积;
(1)从外观无法区分三者,区分晶体、非晶体、准晶体最可靠的方法是X—射线衍射法。本小题答案为:X-射线衍射。
(2)锑为51号元素,Sb位于第五周期VA族,则基态锑(Sb)原子价电子排布的轨道式为![]() ;[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,[H2F]+中中心原子F的价层电子对数为2+
;[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,[H2F]+中中心原子F的价层电子对数为2+![]() =4,σ键电子对数为2,该离子的空间构型为V型,与[H2F]+具有相同空间构型和键合形式的分子为H2O、阴离子为NH2- 。本小题答案为:
=4,σ键电子对数为2,该离子的空间构型为V型,与[H2F]+具有相同空间构型和键合形式的分子为H2O、阴离子为NH2- 。本小题答案为:![]() ; V型 ;H2O ; NH2-。
; V型 ;H2O ; NH2-。
(3)①H3BO3和NH4BF4涉及的四种元素中第二周期元素是B、N、O、F四种元素,同周期元素从左向右第一电离能呈增大趋势,N的2p能级半充满较稳定,N的第一电离能大于O,则这四种元素第一电离能由大到小的顺序为F>N>O>B。本小题答案为:F>N>O>B。
②[B(OH)4]﹣中B的价层电子对=4+1/2(3+1-4×1)=4,所以B采取sp3杂化。本小题答案为:sp3。
③NH4BF4(四氟硼酸铵)中含铵根离子和氟硼酸根离子,铵根离子中含3个σ键和1个配位键,氟硼酸根离子中含3个σ键和1个配位键,铵根离子和氟硼酸根离子以离子键相结合,则四氟硼酸铵中存在离子键、σ键、配位键。本小题答案为:AB。
(4)键能指气态基态原子形成1mol化学键释放的最大能量。由图a可知,气态基态S(g)和6F(g)原子形成SF6(g)释放的能量为1962kJ,即形成6molS—F键释放的能量为1962kJ,则形成1molS—F键释放的能量为1962kJ÷6=327kJ,则S—F的键能为327kJ·mol-1。本小题答案为:327。
(5)①CuCl的熔点为426℃,熔化时几乎不导电,CuCl是分子晶体,而CuF的熔点为908℃,CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力,故CuF比CuCl熔点高。本小题答案为:由两者的熔点可知,CuCl是分子晶体,而CuF为离子晶体,CuF离子晶体的晶格能大于CuCl分子间范德华力。
<>②晶胞中Cu+数目为8×1/8+6×1/2=4,F-数目为4,故晶胞质量=(4×64+4×19)g÷NA =(4×83)/NA g,根据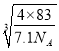 ×107nm。本小题答案为:
×107nm。本小题答案为: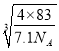 ×107。
×107。 
 阅读快车系列答案
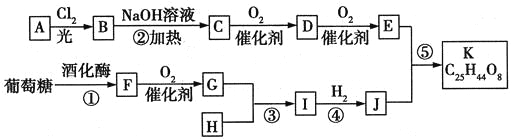
阅读快车系列答案【题目】丙烯酸酯类物质广泛用于建筑、包装材料等,丙烯酸是合成丙烯酸酯的原料之一。丙烯醇可用于生产甘油、塑料等。以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:

已知:
①2CH2=CH-CHO+NaOH![]() CH2=CHCH2OH+CH2=CHCOONa
CH2=CHCH2OH+CH2=CHCOONa
②2CH2=CHOONa+H2SO4→2CH2=CHCOOH+Na2SO4
③有关物质的相关性质如表:
物质 | 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | - 87 | - 129 | 13 | -22.8 |
密度/g·mL-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和有机溶剂 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 难溶于水 |
(1)操作①需要连续加热30min,所用装置如图所示。仪器L名称是________。

(2)操作②使用的主要仪器是分液漏斗,在使用之前需进行的操作是 ___。
(3)操作④包括____、过滤、冰水洗涤、低温吸干。
(4)操作⑤中,加热蒸馏“下层液体”,分离出四氯化碳;再分离出丙烯醇(如图),要得到丙烯醇应收集 ____(填温度)的馏分。图中有一处明显错误,应改为____。

(5)测定丙烯醇的摩尔质量:准确量取amL丙烯醇于分液漏斗中,烧瓶内盛装足量钠粒。实验前量气管B中读数为b mL,当丙烯醇完全反应后,冷却至室温、调平B、C液面,量气管B的读数为c mL。已知室温下气体摩尔体积为VL·mol-1。

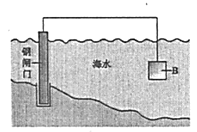
调平B、C液面的操作是____;实验测得丙烯醇的摩尔质量为____g·mol-1(用代数式表示)。如果读数时C管液面高于B管,测得结果将____(填“偏大”“偏小”或“不变”)。