题目内容
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
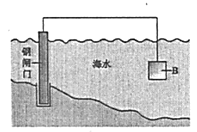
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。

(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:

a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
【答案】O2+4e-+2H2O=4OH- Zn 阴 滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生 H2-2e-+2OH-=2H2O 0.4
【解析】
(1)①钢铁在海水中发生电化学腐蚀的正极反应取决于电化学腐蚀的类型,按类型书写即可;
②由图判断防护方法是原电池原理,据此可以选择材料B;
(2)图知钢铁防护的方法是电解方法,则可判断铁是阴极;检测钢铁保护效果的方法是:检测铁电极附近的溶液中的亚铁离子浓度;
(3)①通过通入电极a的反应物是氢气,判断电极是负极,书写电极反应式;
②按电池反应方程式,结合已知条件:电池共产生3.6g水,即可计算电路中通过电子的物质的量。
(1)①钢铁在海水中发生吸氧腐蚀,则正极反应式为:O2+4e-+2H2O=4OH-;
答案为:O2+4e-+2H2O=4OH-;
②由图判断防护方法是原电池原理,要保护铁,铁作原电池的正极,那么负极就选比铁活泼的金属锌;
答案为:Zn;
(2)图知钢铁防护的方法是电解方法,是外接电源的阴极保护法,则铁是阴极;检测钢铁保护效果的方法是:检测铁电极附近的溶液中的亚铁离子浓度,浓度越低保护效果就越好,因此可取铁电极附近的溶液少量,滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生,则保护效果好;
答案为:阴;滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生;
(3)氢氧燃料电池是一种新型的化学电源,
①通入电极a的反应物是氢气,则电极a是负极,氢气在负极发生氧化反应,因为电解质是碱溶液,则其电极反应式为H2-2e-+2OH-=2H2O;
答案为:H2-2e-+2OH-=2H2O
②按电池反应方程式![]() ,则
,则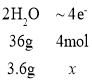 ,得x=0.4mol;
,得x=0.4mol;
答案为:0.4。

【题目】用如图所示装置(夹持已装置省略)进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀硫酸 | Na2CO3 | CaCl2溶液 | CO2可与氯化钙反应 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. AB. BC. CD. D
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。