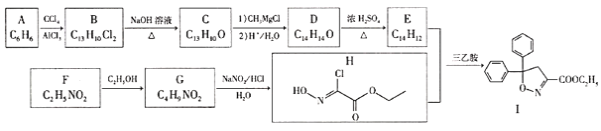
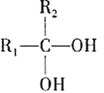
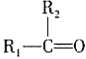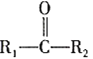题目内容
【题目】储氢材料是一类能可逆地吸收和释放氢气的材料。LaNi5合金、NaBH4、H3B-NH3、Mg2NiH4等都是潜在储氢材料。回答下列问题:
(1)基态Ni原子的核外电子排布式为____,有___________个未成对的电子;
(2)NaBH4中H为-1价,Na、B、H电负性由大到小的顺序是_________。BH4-离子的立体构型为________,其中B的杂化轨道类型为_____。
(3)B2H6和NH3化合可以生成H3B-NH3,H3B-NH3加热时发生反应:H3B-NH3=BN+3H2,缓慢释放出H2。BN有类似于石墨的结构,B2H6、NH3和BN的沸点由高到低的顺序为_________, 原因是___。
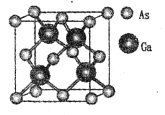
(4)X-射线衍射分析表明,Mg2NiH4 的立方晶胞的面心和顶点均被Ni原子占据,所有Mg原子的Ni配位数都相等。则Mg原子填入由Ni原子形成的_____空隙中(填“四面体”或“八面体”),其空隙占有百分率为_____。
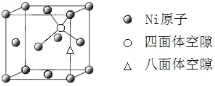
(5)已知Mg2NiH4 晶体的晶胞参数为646.5 pm,液氢的密度为0.0708 g·cm-3。若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则Mg2NiH4 的储氢能力是液氢的___倍(列出计算式即可)。
【答案】1s22s22p63s23p63d84s2 2 H、B、Na 正四面体 sp3 BN、NH3、B2H6 BN属于混合型晶体 ,熔沸点较高;NH3和B2H6 属于分子晶体, NH3分子间有氢键,而B2H6 分子没有,所以NH3的沸点高于B2H6 四面体 100% 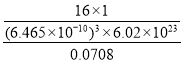
【解析】
(1)Ni原子核外有28个电子,其核外电子排布式为1s22s22p63s23p63d84s2,d能级上有8个电,d能级有5个轨道,所以有2个未成对的电子,故答案为:1s22s22p63s23p63d84s2;2。
(2)NaBH4中H为-1价,Na为+1价,Na、B、H电负性由大到小的顺序是H>B>Na,BH4-的中心原子价电子对数为4,无孤对电子,立体构型为正四面体,B的杂化轨道类型为sp3,故答案为:H、B、Na;正四面体;sp3。
(3)NH3和B2H6 属于分子晶体, NH3分子间有氢键,而B2H6 分子间没有氢键,所以NH3的沸点高于B2H6,BN有类似于石墨的结构,石墨是混合晶体,BN属于混合型晶体 ,熔沸点较高,故答案为:BN、NH3、B2H6;BN属于混合型晶体 ,熔沸点较高;NH3和B2H6 属于分子晶体, NH3分子间有氢键,而B2H6 分子没有,所以NH3的沸点高于B2H6。
(4)由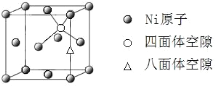 ,可知,Ni原子个数为4,所有Mg原子的Ni配位数相等,Mg原子数目为8,则Mg原子填入由Ni原子形成的四面体空隙中其,空隙占有百分率为100%,故答案为:四面体;100%。
,可知,Ni原子个数为4,所有Mg原子的Ni配位数相等,Mg原子数目为8,则Mg原子填入由Ni原子形成的四面体空隙中其,空隙占有百分率为100%,故答案为:四面体;100%。
(5)储氢能力=晶体密度×氢的质量分数/液氢密度=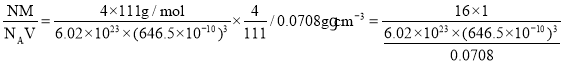 ,故答案为:
,故答案为: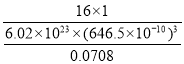 。
。

 名校课堂系列答案
名校课堂系列答案【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
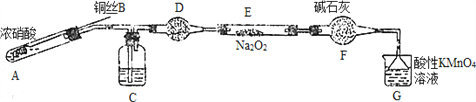
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。