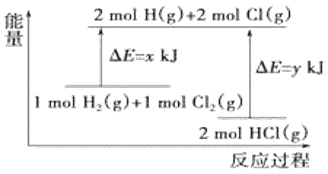
题目内容
【题目】室温下,下列有关结论正确的是( )
A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小
B.将CH3COONa溶液从20℃升温至30℃,![]() 溶液中增大
溶液中增大
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸
【答案】C
【解析】
A. 向稀醋酸中加水稀释,能促进醋酸电离,使电离程度增大,氢离子物质的量增大,但是由于体积增大,氢离子浓度反而减小,所以溶液的pH增大,A错误;
B. 水解吸热,升高温度能促CH3COONa水解,使水解常数Kh变大,根据反应CH3COO-+H2O![]() CH3COOH+-OH-,Kh=
CH3COOH+-OH-,Kh=![]() ,则
,则![]() ,Kh变大,
,Kh变大,![]() 比值减小,B错误;
比值减小,B错误;
C. 向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,有c(H+) = c(OH-),反应后溶液中存在的阳离子有Na+、NH![]() 和H+,阴离子有SO
和H+,阴离子有SO![]() 、HSO
、HSO![]() 和OH-,则有电荷守恒关系c(Na+)+c(NH
和OH-,则有电荷守恒关系c(Na+)+c(NH![]() ) +c(H+) =2c(SO
) +c(H+) =2c(SO![]() )+c(HSO
)+c(HSO![]() )+ c(OH-) ,所以c(Na+)+c(NH
)+ c(OH-) ,所以c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(HSO
)+c(HSO![]() ),C正确;
),C正确;
D. 当HA-的电离程度大于水解程度时,此时NaHA是酸性,pH<7,所以pH<7时,H2A不一定是强酸,D错误。
答案选C。

【题目】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。